BIP 2024 N°1

EDITORIAL
Lutter contre la désinformation médicale, pour le bien des patients !
La désinformation médicale est un phénomène qui n’est pas nouveau. Il y a déjà 20 ans, le Sunday Times révélait que la publication de Wakefield dans le Lancet affirmant l’existence d’un lien entre la vaccination Rougeole-Oreillons-Rubéole et l’autisme reposait sur des données fausses. La fameuse théorie de « l’entérocolite autistique » devient alors fumeuse. Les motivations de l’auteur radié de l’Ordre des médecins britanniques en 2010 étaient sans doute plus financières que scientifiques, puisqu’il avait signé pour réaliser cette étude un contrat lui demandant d’apporter une preuve irréfutable de la dangerosité de ce vaccin, et qu’il avait lui-même déposé un brevet pour un vaccin contre la rougeole, qui aurait pu avoir sa place si la forme combinée n’était plus recommandée.
Aujourd’hui comme il y a 20 ans, il est primordial de lutter contre la désinformation médicale, d’autant plus qu’elle se propage encore plus facilement aujourd’hui. Nous en avons eu l’illustration ces dernières années, avec la diffusion d’informations en quantité croissante, la multiplication des spécialistes autoproclamés du médicament et des épidémies, et la facilité de communiquer via les médias et les réseaux sociaux.
Cette désinformation a des conséquences néfastes pour la santé de la population, soit par la communication autour de risques non avérés (en particulier pour les vaccins qui sont les seuls médicaments capables de faire disparaitre une maladie), soit par la promotion d’interventions à visée thérapeutique dont l’efficacité n’est pas démontrée.
L’information fiable concernant le bon usage du médicament, basée sur des faits scientifiques démontrés par des méthodologies dont les avantages et les limites sont maitrisés, fait partie des missions des pharmacologues. C’est pourquoi la communauté des pharmacologues, sous l’égide de la Société Française de Pharmacologie et Thérapeutique, soutient la tribune de l’Expresse de janvier 2024 sur la propagation des fausses informations médicales et vous propose de signer la pétition en ligne.
Agnès Sommet
Sommaire
- INFOS IMPORTANTES - ALERTES
- PHARMACOLOGIE CLINIQUE
- PHARMACOVIGILANCE
- PHARMACO-EPIDEMIOLOGIE
- MEDICAMENTS, REPRODUCTION ET PERINATALITE
- PHARMACOLOGIE SOCIALE
- ADDICTOVIGILANCE
- PHARMACOLOGIE-TOXICOLOGIE
VOTRE SERVICE DE PHARMACOLOGIE MEDICALE
Les pharmacologues médicaux sont des spécialistes du médicament, médecins et pharmaciens, qui ont pour missions l’évaluation et le suivi de l’efficacité et de la sécurité des médicaments, les vigilances associées aux médicaments et aux drogues, l’information sur le bon usage du médicament et l’enseignement de la pharmacologie médicale auprès des étudiants en santé et des professionnels de santé. Les services de pharmacologie médicale et toxicologie des CHU de Montpellier et de Toulouse regroupent plusieurs structures médicales : centres régionaux de pharmacovigilance et d’information sur le médicament, centres d’addictovigilance, laboratoires de toxicologie et de suivi thérapeutique pharmacologique, unités de pharmacologie clinique et pharmaco-épidémiologie et unité de prévention du dopage.
CHU Toulouse
Service de Pharmacologie Médicale et Clinique
Pr Agnès Sommet
37 allées Jules-Guesde, 31000 Toulouse, France
Centre Régional de Pharmacovigilance, de PharmacoEpidémiologie et d’Informations sur le Médicament (CRPV)
Centre d’Evaluation et d’Informations sur la Pharmacodépendance et d'AddictoVigilance (CEIP-A)
Antenne Médicale de Prévention du Dopage et des conduites dopantes d’Occitanie (Centre Pierre-Dumas)
Evaluation chez la Femme Enceinte des MEdicaments et de leurs RISques (EFEMERIS)
CHU Montpellier
Service de Pharmacologie Médicale et Toxicologie
Dr Olivier MATHIEU
Hôpital Lapeyronie, 371 Avenue du Doyen Gaston Giraud, 34295 Montpellier, France
Centre Régional de Pharmacovigilance (CRPV)
Déclaration en ligne : https://signalement.social-sante.gouv.fr/
Centre d’Addictovigilance
Laboratoire de Toxicologie et de Suivi Thérapeutique Pharmacologique
Informations importantes et alertes concernant le bon usage et la sécurité des médicaments
ANSM
Recommandations pour le bon usage des antibiotiques (20/12/2024) : lien
Renforcer l’information des professionnels de santé pour une utilisation sécurisée du chlorure de potassium (KCl) injectable (04/01/2024) : lien
Nouvelles données en faveur d’un risque accru de saignements menstruels abondants après la primovaccination contre le Covid-19 (24/01/2024) : lien
Interdiction de la publicité auprès du grand public pour l’ibuprofène 400 mg (08/02/2024) : lien
Adagrasib: risque potentiel d'effets indésirables cutanés sévères (11/01/2024) : lien
Pseudoéphédrine : risques de syndrome d’encéphalopathie postérieure réversible (PRES) et de syndrome de vasoconstriction cérébrale réversible (RCVS) (12/02/2024) : lien
Difficultés d'approvisionnement en méthylphénidate : l’ANSM publie des recommandations pour les pharmaciens (22/02/2024) : lien
EMA
Le comité de pharmacovigilance (PRAC) de l’Agence européenne des médicaments (EMA) rappelle le risque d’effets indésirables graves de Paxlovid (nirmatrelvir, ritonavir) en cas d'association avec certains immunosuppresseurs (19/02/2024) : lien
SFPT
Toujours pas de pertinence clinique pour les anticorps dirigés contre la substance amyloïde dans la maladie d’Alzheimer (24/12/2023) : lien
Une piste pour la cardioversion pharmacologique (24/12/2023) : lien
Synthèse de protéines alternatives induite par les vaccins ARNm (08/01/2024) : lien
Thérapeutiques d’épargne de la fonction β pancréatique dans le diabète de type 1 : des perspectives encourageantes (15/01/2024) : lien
Oseltamivir (Tamiflu®) : pas d’effet significatif sur la réduction du risque d’hospitalisation en traitement curatif de la grippe (24/01/2024) : lien
Tirzépatide et maintien de la perte de poids au cours du temps (12/02/2024) : lien
Transmission iatrogène de protéines béta-amyloïdes avec la possible induction de maladies d’Alzheimer (12/02/2024) : lien
L’UTILISATION DU SAFRAN DANS LE TROUBLE DEFICITAIRE DE L’ATTENTION/HYPERACTIVITE (TDAH)
Aurélie Bobet (Interne en pharmacie), Haleh Bagheri, François Montastruc (Toulouse)

Le trouble déficitaire de l’attention/hyperactivité (TDAH) est un trouble neuro-développemental de l’enfant/adolescent. Les thérapies comportementales et psychosociales semblent efficaces pour réduire les symptômes. Quand celles-ci sont insuffisantes, un traitement par méthylphénidate (MPH), amphétaminique psychostimulant, est proposé. Le profil de risque du methylphénidate comprend notamment des effets indésirables cardiovasculaires (arythmie, infarctus du myocarde, …) et neuropsychiques (insomnie, nervosité, hallucination, …). Sur ces 20 dernières années, l'usage de plantes médicinales telles que le safran (Crocus sativus) a été envisagé comme un complément à la prise en charge médicale conventionnelle (1).
L’action centrale du safran pourrait être une augmentation des tonus dopaminergique, sérotoninergique, noradrénergique et glutamatergique. Les propriétés pharmacodynamiques du safran seraient multiples : cytotoxique, antimicrobien, antioxydant, antidépressif, anticonvulsionnant (2).
L’évaluation clinique du safran repose actuellement sur 2 essais cliniques en particulier. Le premier incluait 50 patients et a comparé l’efficacité du safran par rapport MPH. Aucune différence significative n’a été mise en évidence entre les deux groupes (MPH seul et safran seul) (3). Un deuxième essai incluant 70 patients avait pour objectif de montrer que le MPH associé au safran avait une meilleure efficacité que le MPH seul. L’efficacité du groupe MPH + safran était cliniquement significatif sur la réduction des symptômes du TDAH (4). Néanmoins, cette étude comportait des limites notamment par l’absence de suivi au long cours et d’analyse des résultats en aveugle.
Concernant les effets indésirables, les différentes études rapportent des nausées, vomissements, diarrhées, et des saignements notamment utérin (effet emménagogue), a priori sans effet dose-dépendant, ainsi que des réactions anaphylactiques (3,5,6). Le safran modifierait légèrement certains paramètres biologiques : pression artérielle systolique, plaquettes/INR/temps de saignement, créatinine (6). Ces effets indésirables pourraient s’expliquer par les propriétés sérotoninergique et noradrénergique.
En conclusion, les données actuelles ne sont pas assez robustes pour conclure à une efficacité du safran dans le TDAH. Les études disponibles présentent des limites méthodologiques et d’autres études à plus large échelle et robuste sur le plan méthodologique s’avèrent nécessaires.
En pratique, en considérant ces données et le profil de risque, le safran ne peut être recommandé dans l’indication du TDAH.
Bibliographie
1. Golsorkhi H et al. Herbal medicines in the treatment of children and adolescents with attention-deficit/hyperactivity disorder (ADHD): An updated systematic review of clinical trials. Avicenna J Phytomed. 2023;13:338-353
2. Butnariu M et al. The Pharmacological Activities of Crocus sativus L.: A Review Based on the Mechanisms and Therapeutic Opportunities of its Phytoconstituents. Oxid Med Cell Longev. 2022; 2022:8214821. doi: 10.1155/2022/8214821. eCollection 2022
3. Baziar S et al. Crocus sativus L. Versus Methylphenidate in Treatment of Children with Attention-Deficit/Hyperactivity Disorder: A Randomized, Double-Blind Pilot Study. J Child Adolesc Psychopharmacol. 2019;29:205 12.
4. Khaksarian M et al. A Comparison of Methylphenidate (MPH) and Combined Methylphenidate with Crocus sativus (Saffron) in the Treatment of Children and Adolescents with ADHD: A Randomized, Double-blind, Parallel-Group, Clinical Trial. Iran J Psychiatry Behav Sci. 2021;15:e108390. https://doi.org/10.5812/ijpbs.108390.
5. Schmidt M et al. Saffron in phytotherapy: Pharmacology and clinical uses. Wien Med Wochenschr. 2007;157:315.
6. Modaghegh MH et al. Safety evaluation of saffron (Crocus sativus) tablets in healthy volunteers. Phytomedicine. 2008;15:1032.
EFFETS INDESIRABLES DANS LES ESSAIS CLINIQUES EN CANCEROLOGIE : LES GRADES 1 ET 2 SONT AUSSI A PRENDRE EN COMPTE MAIS…
Pascale Olivier (Toulouse)
Dans les essais cliniques (EC) en cancérologie, tous les « événements indésirables » (EvI) sont normalement recueillis et leur intensité est évaluée de façon standardisée avec le Common Terminology Criteria for Adverse Events (CTCAE) : les EvI sont classés selon 5 niveaux d’intensité (grade 1 à 5). Cependant, dans certains EC, seuls les EvI de grade > 3 sont recueillis, estimant que les EvI de grades léger à modéré (1 et 2) sont peu susceptibles d'affecter la sécurité des participants et/ou les critères de jugement.
Récemment, une analyse secondaire d’un EC de phase III incluant 529 patients traités pour une leucémie chronique par ibrutinib ou chimiothérapie injectable par fludarabine- cyclophosphamide - rituximab, a évalué la relation entre les « effets indésirables » (EI) de grade 1-2 et «la gêne » subie par les patients et les arrêts de traitement (1).
La survenue d’EI de grade 1 et 2 a impacté négativement le suivi du traitement de 13% et de 35% respectivement. Seuls les EI « symptomatiques » ont eu cet impact (en comparaison des EI « asymptomatiques »). La survenue d’EI de grade 2 a entrainé une augmentation de 59% (IC 95% ; 1,32-1,95) des interruptions de traitement, plus importante en cas de caractère symptomatique des EI.
Les grades de sévérité minimes (1 et 2) ont donc un impact significatif sur les interruptions de traitement et devraient être plus pris en compte dans les analyses de résultats d’EC. Ce type de données est essentiel pour mieux soutenir les patients au quotidien qui subissent des EI, même de faible intensité, dans le but d’optimiser l’observance du traitement. Cependant, même si la collecte des EvI est essentielle pour s'assurer de l'efficacité d’un traitement donné, sans augmentation d’EI significatifs, il faut tenir compte du temps et du coût nécessaires à cette collecte au niveau des centres investigateurs. Dans l’étude citée, pas moins de 18 028 « effets indésirables » ont été collectés, dont 16 301 de grade 1-2 (90%) ! Se pose alors la question de la pertinence, dans tous les EC, de recueillir tous les EvI de grade léger à modéré : faut-il se concentrer sur certains types d’EvI ? Sur les EvI « symptomatiques » (qui entrainent le plus d’interruption de traitement) ? Ne les recueillir que dans le groupe expérimental (ceux du groupe contrôle étant déjà connus) ? Faut-il inventer des méthodes de recueil plus interactives ?
Il est impossible de répondre suite à ce travail, limité par l’analyse des EvI d’un seul EC, mais il faut a minima se poser ces questions lors de la rédaction des protocoles, afin de trouver un compromis entre améliorer la qualité de vie des patients et accroître l'adhésion au traitement (et donc sans doute l’efficacité), et la charge de travail que représente un tel recueil.
RISQUES POTENTIELS D’UNE EXPOSITION CHRONIQUE AU MINOXIDIL TOPIQUE
Sawsan El Hussein, Véronique Pinzani (Montpellier)
Le minoxidil (2% ou 5%) est indiqué en cas de chute de cheveux modérée (alopécie androgénique) de l'adulte, homme ou femme. Son mécanisme d’action implique divers effets : vasodilatateur, anti-androgène, anti-inflammatoire, inducteur de la voie de signalisation Wnt/β-caténine (un régulateur principal des cellules de la matrice du cheveu au cours de la morphogenèse du cheveu et de la régénération des follicules pileux) (1). Dans les conditions normales d’utilisation, une quantité moyenne de 1,7% de la dose appliquée passe dans la circulation générale (2). Ce passage s’accroit avec la fréquence d’application par jour, la durée du traitement, l’état de la peau et l’âge du patient.
Cas rapporté au CRPV de Montpellier : Survenue d’une névrite optique et d’une dysgueusie à la suite d’une application journalière (2 fois par jours) pendant 10 ans de minoxidil 5% chez un usager de 68 ans, non régressive malgré l'arrêt du traitement depuis 1 an. L’examen ophtalmologique identifiait une atrophie optique bilatérale de type glaucomateuse avec diminution de l’épaisseur des fibres du nerf optique et diminution de cellules ganglionnaires.
Dans la littérature, on retrouve des cas de choriorétinopathie, de neuropathie optique ischémique et d’occlusion de l'artère rétinienne suite à une utilisation à long terme du minoxidil. Les hypothèses mécanistiques évoquées impliquent : l’ouverture du canal potassique KATP induisant une hyperpolarisation et une réduction de l’excitabilité cellulaire, une action sur l’angiogenèse, une augmentation de perméabilité vasculaire médiée par le VEGF (facteur de croissance endothélial vasculaire), ou une hyperactivité sympathique entrainant une vasodilatation choroïdienne et donc une toxicité possible sur les cellules de l’épithélium pigmentaire (3-6).
En officine, le minoxidil peut être en accès direct aux patients. Le RCP indique qu’il doit être réservé à l’adulte avec une dose quotidienne ne dépassant pas 2ml (soit 14 pulvérisations/ jour) et son utilisation n’est pas recommandée chez les personnes âgées en l’absence d’études réalisées dans cette population.
Bien que ces affections oculaires ne soient pas mentionnées dans le RCP, il convient de rappeler aux patients le bon usage du minoxidil, surtout en cas d’antécédent oculaire.
1. Gupta AK, Talukder M, Venkataraman M, Bamimore MA. Minoxidil: a comprehensive review. J Dermatolog Treat. 2022 Jun;33(4):1896-1906.
3. Richer C, Pratz J, Mulder P, et al. 1990. Cardiovascular and biological effects of K+ channel openers, a class of drugs with vasorelaxant and cardioprotective properties. Life Sci 47: 1693–1705.
4. Guillon-Rolf R, Boutboul S, Borderie V. Choriorétinopathie séreuse centrale et minoxidil 2 [Central serous chorioretinopathy associated with minoxidil 2]. J Fr Ophtalmol. 2020 Dec; 43(10):e369-e370.
5. Scarinci F, Mezzana P, Pasquini P, Colletti M, Cacciamani A. Central chorioretinopathy associated with topical use of minoxidil 2% for treatment of baldness. Cutan Ocul Toxicol. 2012 Jun;31(2):157-9.
6. Lachgar S, Charveron M, Gall Y, Bonafé J-L. Minoxidil upregulates the expression of vascular endothelial growth factor in human hair dermal papilla cells. Br J Dermatol 1998;138:407—11.
IDEES REÇUES SUR LES ALLERGIES AUX ANTIBIOTIQUES
Léo-Darius Ghoreishi (interne), Christelle Philibert (Montpellier)
Les allergies médicamenteuses constituent une problématique majeure dans la prise en charge ambulatoire et hospitalière. Les antibiotiques sont les médicaments les plus fréquemment en cause avec notamment les bêtalactamines, puis les fluoroquinolones, les sulfamides antimicrobiens, les macrolides et enfin les antituberculeux (la prévalence des réactions allergiques dépend notamment de leur fréquence de prescription).
On estime que jusqu'à 20% des patients hospitalisés déclarent être allergiques à au moins un médicament, ce qui soulève des défis significatifs en matière de prescription médicale (1).
Toutefois, il est important de noter que la plupart (90%) des prétendues allergies aux antibiotiques ne sont pas véritablement des réactions allergiques (2). Ce diagnostic erroné peut entraîner une augmentation de la prescription d'antibiotiques de deuxième ligne ou à spectre plus large, contribuant ainsi à l'émergence de résistances. Il est donc primordial de clarifier et de confirmer avec précision ces allergies avant de les consigner dans le dossier d'un patient, car une fois mentionnées, elles peuvent être difficiles à retirer. Par ailleurs, il est préférable d’utiliser le terme « hypersensibilité » au terme « allergie » si un diagnostic précis n’a pas été posé.
De plus, il est important de ne pas surestimer les allergies croisées, car elles sont moins fréquentes qu'on ne le pense. Par exemple, le risque d'allergie croisée entre les pénicillines et les céphalosporines de troisième génération (C3G) est inférieur à 2% (2).
Un interrogatoire approfondi du patient est essentiel pour évaluer la probabilité et le type d'allergie. Pour les pénicillines, l’utilisation d’un score d’aide à la décision tel que test PEN-FAST peut aiguiller sur le diagnostic d’allergie.
La meilleure façon de confirmer une allergie est de réaliser des tests allergologiques (épidermotests voire test de provocation). Une collaboration étroite entre allergologues et médecins prescripteurs est essentielle pour une gestion efficace des allergies aux antibiotiques, n’hésitez pas à proposer une consultation allergologique en cas de suspicion d’allergie.
UN PROGRAMME D’ACCES CONTROLE (PAC) POUR LA FENFLURAMINE : SERA-T-IL EFFICACE CONTRE LE MESUSAGE ?
Pauline Schiro, François Montastruc, Haleh Bagheri (Toulouse)
Les programmes d’accès restreints font partie des mesures additionnelles de réduction du risque qui ont pour objectif de réduire le mésusage, de prévenir ou réduire la probabilité de survenue d'effets indésirables, leur gravité et/ou l'impact sur le patient. Ces mesures peuvent être demandées par les autorités de santé nationales ou européenne après l’obtention de l’Autorisation de Mise sur le Marché, mais aussi à tout moment de la vie du médicament dès lors qu’un signal de sécurité est évalué.
Un exemple est la mise en œuvre du programme d’accès contrôlé pour la fenfluramine (nom commercial : Fintepla®). La fenfluramine est un anorexigène amphétaminique entrainant la libération de sérotonine qui va stimuler plusieurs sous-types de récepteurs 5-HT. Elle est indiquée dans l’épilepsie associée au syndrome de Dravet et au syndrome de Lennox-Gastaut (1).
La fenfluramine expose à des risques de valvulopathies et d’hypertension artérielle pulmonaire. Ces effets indésirables s’expliquent principalement par l’action agoniste sérotoninergique 5-HT2B. La fenfluramine possède des propriétés anorexigènes et peut donc faire l’objet d’un mésusage (comme avec le benfluorex, MEDIATOR®) (2).
Ce PAC consiste en la réalisation d’une formation en ligne obligatoire pour prescrire la fenfluramine. Elle permet au prescripteur d’obtenir son numéro d’identification (n° PAC), qui devra être inscrit sur chaque ordonnance pour permettre la délivrance du médicament. Théoriquement, le PAC permettrait de garantir le respect strict de l’indication et d’assurer la sensibilisation des médecins sur les risques de ce médicament (3,4).
On peut s’interroger sur l’efficacité de ce programme. Exemple : la mise en place pour les médicaments à base d’hydroxyéthylamidon exposant à un risque accru d'atteinte rénale et de décès (5) n’a pas empêché la persistance du non-respect des contre-indications et des précautions d’emploi. Au final, les autorisations de mise sur le marché de ces médicaments ont été suspendues (6).
En pratique, les mesures mises en place pour réduire le risque de mésusage pourraient ne pas suffire. L’acquisition d’une culture pharmacologique pour pouvoir prédire et mesurer les risques d’un médicament constitue un moyen plus efficace et durable pour garantir le bon usage du médicament.
1.Fintepla® 2,2 mg/mL, solution buvable Résumé des caractéristiques du produit
2. Lechat Philippe, Propriétés Pharmacologiques du benfluorex, Afssaps, 31 décembre 2010
3. https://ansm.sante.fr/tableau-marr/fenfluramine
RISQUE ISCHÉMIQUE CHEZ LES PATIENTS INITIANT DES TRIPTANS : UNE ÉTUDE CASE-CROSSOVER
Jean-Luc Faillie (Montpellier)
En raison de leur effet vasoconstricteur, la sécurité cardiovasculaire des triptans suscite des inquiétudes. Une étude menée à partir des registres nationaux danois (1995-2022) a examiné l'association entre l’initiation de triptans et les événements ischémiques tels que l'infarctus du myocarde et l'accident vasculaire cérébral (1).
L'étude a utilisé un design case-crossover, une méthode robuste pour contrôler les biais de confusion car chaque patient est son propre témoin : on compare l'exposition aux triptans dans la période de deux semaines précédant un événement ischémique avec quatre périodes de référence de deux semaines.
Parmi les 429 612 initiateurs de triptans identifiés, principalement des femmes (75,8%) avec un âge médian de 38 ans, 11 (0,003%) ont présenté un infarctus du myocarde dans les 2 semaines suivantes (OR=3,3 ; IC à 95 %, 1,0-10,9) et 18 (0,004%) un accident vasculaire cérébral ischémique (OR=3,2 ; IC à 95 %, 1,3-8,1). L'âge médian des patients concernés était d'environ 60 ans et ils présentaient un profil de risque cardiovasculaire élevé.
Les résultats montrent une association entre l'initiation de triptans et un risque accru d'accident vasculaire cérébral ischémique et d'infarctus du myocarde. Cependant, pour les patients présentant un faible risque cardiovasculaire, le risque ischémique était très faible. Il est donc crucial de bien peser les bénéfices et les risques individuels lors de la prise en charge des patients migraineux.
ALLONGEMENT DU QT AVEC LA QUETIAPINE OU L’HALOPERIDOL : UN EFFET INDESIRABLE CONNU MAIS A NE PAS NEGLIGER !
Romain Barus (Toulouse)
La quétiapine et l’halopéridol sont des neuroleptiques pour lesquels l’allongement du QT est décrit dans leur monographie comme peu fréquent et rare, respectivement. A ce jour, seule la monographie de l’halopéridol recommande la réalisation d’un ECG à l’initiation et pendant le traitement.
Une étude de cohorte rétrospective taiwanaise, réalisée à partir de dossiers médicaux enregistrés dans une base de données s’est intéressée à évaluer l’incidence des allongements sévère du QTc (définie par un QTc>500ms ou une augmentation du QTc>60ms de la valeur basale) chez les patients ayant débuté un traitement par quétiapine ou halopéridol (1). L’augmentation moyenne du QTc après la prise de quétiapine (n=8832 ; âge moyen de 68,6 ans ; 59% d’hommes) ou d’halopéridol (n=2341 ; âge moyen de 66 ans ; 64,6% hommes) était respectivement de 8,3 +/-51,8ms et 8,9 +/-44,0ms. Treize pour cent des patients initiant la quétiapine et 14,2% l’halopéridol ont développé un allongement sévère du QTc. Les facteurs de risque d’allongement du QT communs aux deux médicaments étaient : l’âge, l'insuffisance cardiaque, l'hypokaliémie et l'utilisation d'amiodarone. L’allongement sévère du QT sous quétiapine était associé à un risque significativement augmenté d’arythmies cardiaques (aOR 2,84 ; IC95% 1,95-4,13) et de mort subite d’origine cardiaque (aOR 2,29 ; IC95% 1,44-3,66). Cette association n’était pas statistiquement significative pour l’halopéridol.
Nous pouvons nous interroger sur l’extrapolation de ces résultats dans une population caucasienne compte tenu des facteurs pharmacogénétiques. Les rares données disponibles suggèrent qu’il n’existe pas de différence inter-ethnique sur la valeur basale du QTc (2). Néanmoins, les caucasiens pourraient être plus susceptibles de présenter un allongement de l’intervalle QT induits par les médicaments que les non caucasiens (en raison notamment des risques plus importants de présenter un polymorphisme du CYP2D6 et un polymorphisme du gène KCHN2 codant pour la sous-unité α du canal hERG) (2). Enfin, l’allongement du QT induit par les médicaments pouvant être dose dépendant (3), l’article ne détaille pas les doses moyennes de quétiapine ou d’halopéridol auxquelles ont été exposés les patients.
3. Yoshida K, Hiroyoshi Ti. Dose-dependent effects of antipsychotics on efficacy and adverse effects in schizophrenia." Behavioural brain research 402 (2021): 113098.
LAMOTRIGINE ET ALLAITEMENT MATERNEL
Marie-Andrée Thompson-Bos, Cosette Le Souder (Montpellier)
La lamotrigine est l’antiépileptique de première intention pendant la grossesse pour l'épilepsie et les troubles bipolaires, sur la base de nombreuses données publiées (ANSM, Rapport Antiépileptiques au cours de la grossesse, nov 2023). Cependant, les éléments actuels sur l'allaitement maternel montrent une variabilité interindividuelle et une exposition conséquente de l'enfant allaité avec la survenue possible d'effets indésirables.
La lamotrigine est retrouvée dans le lait maternel (ratio lait/plasma moyen de 0,56) et elle est surtout présente en quantité importante chez les enfants allaités (la Relative Infant Dose, estimant l’exposition de l’enfant allaité, est élevée : entre 9,2 et 18,3%, le seuil de 10% signant une exposition importante).
Cinq enfants exposés in utero à la lamotrigine et allaités ont été suivis au CHU de Montpellier. La durée de l'allaitement était de 3 semaines à 4 mois, les doses maternelles allaient de 50 à 400 mg/jour pour épilepsie (3 cas) ou pour une indication psychiatrique (2 cas). Les enfants ont eu en moyenne 5,2 prélèvements (3 à 7) au cours de leurs six premiers mois de vie. À l'exception d'un nourrisson (posologie maternelle 50 mg/j), tous présentaient au moins un taux plasmatique correspondant à une concentration thérapeutique chez l'adulte (entre 1,2 et 2,9 mg/l ; moyenne = 2,2 mg/l) plus d'un mois après l'accouchement et deux enfants avaient au moins un taux plasmatique attendu chez un adulte traité pour épilepsie (2,8 et 2,9 mg/l).
Les taux plasmatiques ont diminué dans chaque cas avec le passage à une alimentation mixte ou une réduction de la dose maternelle. Trois nourrissons ont présenté transitoirement quelques signes d’hypertonie ou de somnolence. Une neutropénie transitoire et une augmentation des transaminases (autre étiologie non exclue) étaient présentes chez un autre.
Ceci corrobore les données retrouvées dans la Base Nationale de Pharmacovigilance : 15 cas d’effets indésirables rapportés chez des enfants allaités, avec des taux thérapeutiques chez 6 sur les 9 pour lesquels étaient réalisés des dosages plasmatiques.
L'allaitement sous lamotrigine doit donc être envisagé avec prudence, en tenant compte des posologies maternelles, de la nécessité d'une surveillance clinique et de dosages sériques chez les enfants allaités. De plus, les conséquences à long terme chez un nourrisson exposé à un antiépileptique à des niveaux thérapeutiques sont inconnues.
UN PAS VERS LA SÉCURITÉ : LES ANTIDIABÉTIQUES ET LA GROSSESSE
Justine Bénévent (Toulouse)
Lorsqu'une femme enceinte atteinte de diabète nécessite un traitement médicamenteux, la première intention est l'insuline, dont la sécurité pendant la grossesse est bien établie. Cependant, ces dernières années, il a été observé une tendance croissante à l'exposition des femmes enceintes aux médicaments antidiabétiques non-insuliniques. Malheureusement, les données sur leur sécurité pendant la grossesse sont limitées.
Une étude a examiné le risque de malformations congénitales associées aux antidiabétiques tels que les sulfamides hypoglycémiants, les inhibiteurs de la DPP-4, les analogues du GLP-1 et les inhibiteurs du SGLT2(1). Cette étude, menée dans plusieurs pays (incluant 4 pays nordiques, les États-Unis et Israël), a porté sur plus de 50 000 femmes enceintes atteintes de diabète de type 2.
Les résultats des analyses ajustées sur de nombreux facteurs de confusion n'ont pas montré d'augmentation du risque de malformations congénitales majeures après l'exposition à ces médicaments pendant le premier trimestre de la grossesse, comparativement aux grossesses exposées à l'insuline.
Malgré une puissance de l’étude limitée (par exemple, le groupe exposé aux inhibiteurs du SGLT2 comprenait seulement 335 grossesses) et la nécessité d’obtenir des données sur d'autres issues de grossesse que les malformations congénitales, cette étude fournit des données rassurantes quant aux risques associés aux antidiabétiques non-insuliniques pendant la grossesse. Néanmoins, des études complémentaires sont nécessaires pour consolider ces résultats et élargir notre compréhension des effets de ces médicaments sur la santé des femmes enceintes et de leurs enfants à naître.
1. Cesta CE, Rotem R, Bateman BT, Chodick G, Cohen JM, Furu K, et al. Safety of GLP-1 Receptor Agonists and Other Second-Line Antidiabetics in Early Pregnancy. JAMA Intern Med. 2024 Feb 1;184(2):144–52.
DES CROYANCES ERRONÉES RESPONSABLES D’ERREURS MÉDICAMENTEUSES
Sawsan El Hussein, Virginie Bres, Jean-Luc Faillie (Montpellier)
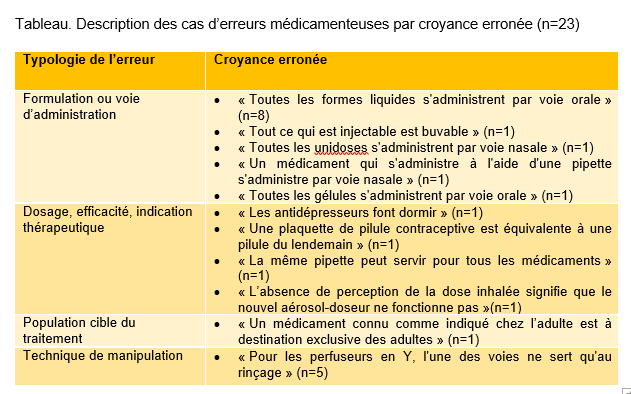
Des erreurs médicamenteuses peuvent se produire lorsque des croyances erronées ou des mauvaises représentations concernent l’usage des médicaments. La voie d’administration, la fréquence, la dose et même l’indication peuvent être concernées. Ces erreurs peuvent par ailleurs survenir à différentes étapes du circuit, impliquant aussi bien les patients que les professionnels de santé. Elles relèvent de biais de jugement ou de raisonnement et sont souvent le résultat d'une « illusion de savoir », parfois même de croyances populaires non fondées sur des preuves scientifiques. Un cas reçu au CRPV de Montpellier illustre cette situation : un homme, souffrant de problèmes nasaux, a sniffé de la poudre d'éconazole, pensant que le suffixe "-nazole" signifiait un usage pour le traitement des affections nasales.
Afin d'identifier d'autres cas d’erreurs induites par des mauvaises croyances, une requête sur la base de données nationale de pharmacovigilance (BNPV) a été réalisée en utilisant une recherche textuelle avec les termes "pensait" ou "croyait" dans les narratifs. Au total, 23 cas ont été identifiés. Ces erreurs résultaient principalement d'une croyance erronée concernant la formulation ou la voie d’administration. Les autres idées fausses concernaient le dosage, l'efficacité ou bien l’indication thérapeutique, la population cible, l’efficacité du dispositif délivrant le produit et la technique de manipulation .
Des croyances erronées concernant l’usage des médicaments peuvent conduire à une utilisation incorrecte et entraîner des effets indésirables parfois graves. La prévention de telles erreurs repose sur une communication efficace entre les patients et les professionnels de santé et souligne l’importance de la culture de la sécurité et de l’éducation en santé.
PHARMACODYNAMIE ARTISTIQUE : LES EFFETS DE LA PSILOCYBINE
Marie Pao, François Montastruc (Toulouse)

La psilocybine est un alcaloïde présent dans certains champignons hallucinogènes (ex : psilocybe). Cette substance possède des effets agonistes mixtes sur les récepteurs sérotoninergiques 5-HT1A, 5-HT2A et 5-HT2C. Elle fait l’objet d’un intérêt renouvelé (est-il justifié ?) pour des indications en psychiatrie comme pour la dépression.
Dans les années 60, de nombreux psychopharmacologues s’intéressent à ces substances qui pourraient modifier l’humeur et la perception des patients. De nombreuses thèses de médecine et expériences sont réalisées. Parmi celles-ci, on retrouve celle du psychiatre et neurologue, le Professeur Jean Delay qui a expérimenté la psilocybine à l’hôpital Saint-Anne à Paris entre 1950 et 1960. Pour comprendre les dérèglements psychiques, les épisodes délirants et les mécanismes de la schizophrénie, on provoque intentionnellement des psychoses grâce à des substances telles que la psilocybine.
On évalue alors les effets pharmacodynamiques de la psilocybine par des expériences artistiques. Le Pr Jean Delay demandait à des peintres parisiens de prendre de la psilocybine puis, juste après de peindre trois toiles : la première doit être identique à un de leurs anciens tableaux, la deuxième doit s’inspirer d’une œuvre qu’ils avaient déjà faîtes et dans la dernière, les peintres peuvent faire ce qu’ils veulent. Entre chaque session de cinq heures, ils doivent reprendre une dose de 2 mg de psilocybine. À la fin de l’expérience, les artistes décrivent leur dynamique de création. Ils rapportent une déformation des formes mais aussi la perte de cette notion. Ils disent que leurs perceptions du temps, des sensations, du rythme et des couleurs sont perturbées. Effectivement, les artistes ont peint beaucoup plus rapidement que lorsqu’ils n’ont pas pris de psilocybine et on remarque un dynamisme dans les traits et la touche sur les peintures. Les sujets déclarent aussi que les objets qu’ils voient sont allongés, étirés et chez les peintres figuratifs les formes éclatent et seules des tâches de couleurs se forment. On peut aussi observer le changement de perception de la couleur dans les tableaux : ils sont plus vifs, intenses et contrastés.
Suite à cette expérience, beaucoup des œuvres produites ont été détruites ou perdues. Ces expériences décrivant les effets pharmacodynamiques de la psilocybine sur la production picturale a fait l’objet d’une exposition organisée en 2015 intitulé « Psilocybine, quand la psychiatrie observe la création ».
Arrivée de petits conditionnements de Tramadol : pourquoi ?
Audrey Fourdan, Yann Freslon (étudiantes en pharmacie) et Anne Roussin (Toulouse)
Le tramadol est l’antalgique opioïde le plus prescrit en France. Il existe une grande variabilité individuelle pour ses effets opioïdes, en raison de la production via le CYP 2D6, soumise à polymorphisme génétique, d’un métabolite actif - O-desméthyl-tramadol - bien plus puissant. Le tramadol agit également sur d’autres neurotransmissions, en particulier sérotoninergique.
Ces différentes propriétés contribuent à :
1- son potentiel de pharmacodépendance avec syndrome de sevrage difficile. Ses effets psychoactifs (anxiolytiques, sédatifs, euphorisants, stimulants) vont inciter les patients à continuer les prises même lorsque la douleur a disparu, avec un risque de développer une véritable addiction avec craving,
2- la survenue d’effet indésirable grave (y compris décès) : risque de dépression respiratoire commun à tous les opioïdes ; risque de syndrome sérotoninergique (à dose thérapeutique lors d’association avec d’autres substances sérotoninergiques ou en cas de surdosage).
Les données récentes d’addictovigilance ont montré une augmentation de l’usage détourné du tramadol pour ses effets psychoactifs « positifs» chez les jeunes (1) (2).
Depuis décembre 2023, afin de réduire le risque de ce mésusage, des boîtes de 10 comprimés ou gélules sont désormais disponibles pour favoriser les traitements de courte durée pour la prise en charge de douleurs aiguës.
Ces petits conditionnements permettront de :
- délivrer le nombre d’unités pharmaceutiques correspondant à la durée d’une prise en charge la plus courte possible,
- limiter le stockage de comprimés/gélules excédentaires dans les pharmacies familiales,
- adapter la quantité délivrée pour les prescriptions libellées “si besoin”,
- pouvoir ne pas délivrer toute la quantité prescrite en une seule fois.
Une communication de l’ANSM accompagnant l’arrivée sur le marché de ces nouveaux conditionnements limités en nombre de comprimés ou gélules de tramadol sera prochainement mis en ligne sur son site (à actualiser si date connue avant parution).
1. Roussin A, Soeiro T, Fouque C, Jouanjus E, Frauger E, Fouilhé N, Mallaret M, Micallef J, Lapeyre-Mestre M; French Addictovigilance Network (FAN). Increase of high‐risk tramadol use and harmful consequences in France from 2013 to 2018: Evidence from the triangulation of addictovigilance data. Br J Clin Pharmacol. 2022 Aug;88(8):3789-3802.
IMPORTANCE ET PRATIQUES DU SUIVI THERAPEUTIQUE PHARMACOLOGIQUE DES ANTITUBERCULEUX
Camille MANÉ, Sarah BAKLOUTI, Peggy GANDIA (Toulouse)
Le Suivi Thérapeutique Pharmacologique (STP) des antituberculeux est essentiel dans diverses situations cliniques (1). En présence de diabète (notamment en cas de gastroparésie sévère), de co-infection par le VIH (surtout en cas de diarrhées chroniques) ou d'autres troubles de l'absorption, le STP est recommandé pour prévenir une baisse d'exposition et garantir l'efficacité thérapeutique. De même, en cas d'insuffisance rénale ou hépatique, le STP est nécessaire en raison de la réduction des capacités d'élimination du patient, ce qui peut entraîner une augmentation de l'exposition et un risque de surdosage, malgré les adaptations posologiques recommandées pour le pyrazinamide et l’éthambutol en cas d'insuffisance rénale sévère (2).
Par ailleurs, le STP est recommandé en cas d'interactions médicamenteuses susceptibles de causer une sous-exposition ou une sur-exposition, ainsi qu'en cas de progression clinique défavorable, afin d'ajuster le traitement si nécessaire.
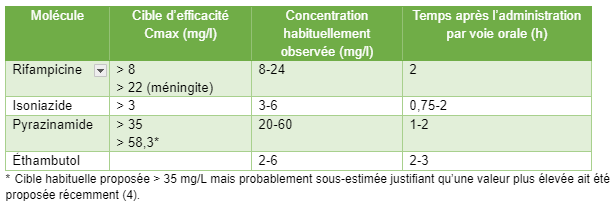
Sur le plan pratique, il est recommandé de réaliser le STP au moins 15 jours après le début du traitement lors de l'utilisation de la rifampicine ou de la rifabutine, en raison de leur effet inducteur enzymatique. Bien que l'exposition (aire sous la courbe) soit considérée comme le meilleur indicateur de l'efficacité thérapeutique et de la toxicité pour les médicaments de première ligne, le STP se base généralement sur la concentration maximale en raison des contraintes pratiques liées à la mesure de l'exposition. Des seuils d'efficacité ont été clairement définis pour la rifampicine, l’isoniazide et le pyrazinamide, tandis que pour les autres molécules, l'interprétation se fait par rapport aux concentrations généralement observées chez les patients (3).
En résumé, le STP émerge comme un outil indispensable pour optimiser les traitements antituberculeux, garantissant à la fois leur efficacité thérapeutique et la sécurité des patients dans une variété de situations cliniques.
1. Nahid P, Dorman SE, Alipanah N, Barry PM, Brozek JL, Cattamanchi A, et al. Official American Thoracic Society/Centers for Disease Control and Prevention/Infectious Diseases Society of America Clinical Practice Guidelines: Treatment of Drug-Susceptible Tuberculosis. Clin Infect Dis Off Publ Infect Dis Soc Am. 1 oct 2016;63(7):e147‑95.
2. World Health Organization. WHO consolidated guidelines on drug-resistant tuberculosis treatment [Internet]. World Health Organization; 2019 [cité 21 nov 2022]. 99 p. Disponible sur: apps.who.int/iris/handle/10665/311389
3. Alsultan A, Peloquin CA. Therapeutic drug monitoring in the treatment of tuberculosis: an update. Drugs. juin 2014;74(8):839‑54.
4. Zheng X, Bao Z, Forsman LD, Hu Y, Ren W, Gao Y, et al. Drug Exposure and Minimum Inhibitory Concentration Predict Pulmonary Tuberculosis Treatment Response. Clin Infect Dis Off Publ Infect Dis Soc Am. 2 nov 2021;73(9):e3520‑8.

BIP Occitanie fait partie de l'International Society of Drug Bulletins (ISDB)