BIP 2024 N°3

EDITORIAL
Retrait de publications scientifiques : pour quel(s) motif(s) ?!
L’éditorial du premier numéro de l’année portait sur la désinformation médicale. Nous y revenons à nouveau, et insistons sur la nécessité de lutter contre cette désinformation, qui entraîne des conséquences néfastes pour la santé de tous. Nous le répétons : « L’information fiable concernant le bon usage du médicament, basée sur des faits scientifiques démontrés par des méthodologies dont les avantages et les limites sont maitrisés, fait partie des missions des pharmacologues. »
La rétractation d’un article scientifique par le comité éditorial d’une revue est un moyen de lutter contre cette désinformation lorsque cette décision est motivée par la mise en évidence de fraude, d’erreurs graves, de résultats falsifiés, de méthodologies fortement biaisées, de procédures non éthiques ou de conclusions non soutenues par les données.
Pour autant, nous ne reconnaissons aucun de ces motifs dans la décision du 26 aout 2024 de rétractation d'un article scientifique coordonné par le Pr JC Lega, initialement publié dans la revue Biomedicine & Pharmacotherapy en février 2024. Cette étude évaluait à 16 990 le nombre de décès liés à l'hydroxychloroquine pour la seule période allant de mars à juillet 2020, en utilisant les données d’hospitalisation et des estimations du risque et du taux de prescription du médicament dans 6 pays dont la France.
Il n’y a pas été révélé de fraude, de falsification de résultats ou de conclusion non soutenue par les résultats de l’étude. Certes, la méthodologie est imparfaite, mais aucune étude n’est parfaite et les conclusions formulées en tenaient compte. Certes, le nombre de décès est une approximation, mais comme toute estimation qui repose sur une part d’incertitude exprimée par le fameux intervalle de confiance.
Il est donc légitime de se poser la question de la réelle motivation de cette rétractation. Surtout lorsque l’on sait que les auteurs de cette étude ont été la cible d'une grande pression de la part des militants « pro-hydroxychloroquine », dans leur vie comme sur les réseaux sociaux.
Si l’intervention de lobbies non scientifiques permet d’aboutir à une telle décision, nous craignons que l’information via les publications scientifiques ne repose plus sur des preuves scientifiques, mais sur les convictions non fondées de groupes d’influence. Dans un tel contexte, nous partageons l’inquiétude de la Société Française de Pharmacologie et Thérapeutique pour le travail des chercheurs et l’avenir de la science qui devrait être régie par la qualité, la rigueur et la probité.
Agnès Sommet, Haleh Bagheri, Jean-Luc Faillie
Sommaire
- INFOS IMPORTANTES - ALERTES
- PHARMACOLOGIE CLINIQUE
- PHARMACOVIGILANCE
- PHARMACO-EPIDEMIOLOGIE
- MEDICAMENTS, REPRODUCTION ET PERINATALITE
- PHARMACOLOGIE SOCIALE
- ADDICTOVIGILANCE
- PHARMACOLOGIE-TOXICOLOGIE
VOTRE SERVICE DE PHARMACOLOGIE MEDICALE
Les pharmacologues médicaux sont des spécialistes du médicament, médecins et pharmaciens, qui ont pour missions l’évaluation et le suivi de l’efficacité et de la sécurité des médicaments, les vigilances associées aux médicaments et aux drogues, l’information sur le bon usage du médicament et l’enseignement de la pharmacologie médicale auprès des étudiants en santé et des professionnels de santé. Les services de pharmacologie médicale et toxicologie des CHU de Montpellier et de Toulouse regroupent plusieurs structures médicales : centres régionaux de pharmacovigilance et d’information sur le médicament, centres d’addictovigilance, laboratoires de toxicologie et de suivi thérapeutique pharmacologique, unités de pharmacologie clinique et pharmaco-épidémiologie et unité de prévention du dopage.
CHU Toulouse
Service de Pharmacologie Médicale et Clinique
Pr Agnès Sommet
37 allées Jules-Guesde, 31000 Toulouse, France
Centre Régional de Pharmacovigilance, de PharmacoEpidémiologie et d’Informations sur le Médicament (CRPV)
Centre d’Evaluation et d’Informations sur la Pharmacodépendance et d'AddictoVigilance (CEIP-A)
Antenne Médicale de Prévention du Dopage et des conduites dopantes d’Occitanie (Centre Pierre-Dumas)
Evaluation chez la Femme Enceinte des MEdicaments et de leurs RISques (EFEMERIS)
CHU Montpellier
Service de Pharmacologie Médicale et Toxicologie
Dr Olivier MATHIEU
Hôpital Lapeyronie, 371 Avenue du Doyen Gaston Giraud, 34295 Montpellier, France
Centre Régional de Pharmacovigilance (CRPV)
Déclaration en ligne : https://signalement.social-sante.gouv.fr/
Centre d’Addictovigilance
Laboratoire de Toxicologie et de Suivi Thérapeutique Pharmacologique
Informations importantes et alertes concernant le bon usage et la sécurité des médicaments
ANSM
Analogues du GLP-1 : point sur la surveillance des effets indésirables graves et mésusages (05/07/2024) : lien
Les autorités de santé alertent sur la circulation croissante d’opioïdes de synthèse (08/07/2024) : lien (cf. article rubrique Addictovigilance)
Thérapies cellulaires CAR-T dirigées contre les antigènes CD19 ou BCMA : risque de tumeur maligne secondaire issue de lymphocytes T (29/07/2024) : lien
Conduites à tenir dans un contexte mondial de fortes tensions en Pegasys (peginterféron alfa-2a) (07/08/2024) : lien
Tensions d’approvisionnement en stylo d’adrénaline Anapen : recommandations et disponibilités des autres stylos (08/08/2024) : lien
Acétate de glatiramère : des réactions anaphylactiques peuvent survenir des mois voire des années après l’instauration du traitement (19/08/2024) : lien
L’autorisation de mise sur le marché du médicament Progesterone Retard Pharlon est suspendue (21/08/2024) :lien
Pronostic à 18 mois des cas de myocardite attribuables à la vaccination ARNm contre le Covid-19 (26/08/2024) : lien
Crayon au nitrate d’argent : restriction des indications et rappel des risques (26/08/2024) : lien
Réévaluation du pictogramme grossesse sur les boîtes de médicaments : lancement d’une consultation publique (05/09/2024) : lien
EMA
Médicaments de la classe des analogues du GLP-1 (glucagon-like peptide-1) : retard de vidange gastrique et risque d’inhalation et de pneumopathie d’inhalation lors d'une anesthésie générale ou d'une sédation profonde (12/07/2024) : lien
Médicaments contenant de l’acétate de médroxyprogestérone à fortes doses (oral et injectable ≥ 100 mg) : nouvelles recommandations pour réduire le risque de méningiome (13/09/2024) : lien
Le phénotypage du déficit en dihydropyrimidine déshydrogénase (DPD) par la mesure du taux d’uracilémie doit être interprété avec prudence chez les patients présentant une insuffisance rénale modérée ou sévère (13/09/2024) : lien
SFPT
Mésusage d’un anti-histaminique H1, cyproheptadine (Periactine®) pour la prise de poids (mise à jour) (15/07/2024) : lien
Intérêt des bêta-bloquants dans la prévention secondaire de l’infarctus du myocarde à fraction d'éjection ventriculaire gauche préservée ? (15/07/2024) : lien
Daridorexant : Une nouvelle stratégie thérapeutique contre l'insomnie chronique
Clément Vallez (étudiant en pharmacie), Virginie Bres et Véronique Pinzani (Montpellier)
L’insomnie chronique touche 10 à 12 % de la population générale. En France, le daridorexant est le premier médicament spécifiquement indiqué pour traiter l'insomnie chronique (présente depuis au moins 3 mois) chez les adultes. Il bénéficie d’un SMR modéré et un ASMR de niveau IV. La posologie recommandée est de 50 mg par jour par voie orale, à prendre 30 minutes avant le coucher.
Le daridorexant est un antagoniste double des récepteurs OX1R et OX2R des orexines, des neuromédiateurs qui interviennent dans le maintien de l’état d’éveil, mais également dans la régulation de l’appétit, de l’humeur et du système de récompense. Dans une étude résumant les résultats des deux essais de phase 3 multicentriques, randomisés, en double aveugle et contrôlés par placebo (1), la supériorité du daridorexant 25 mg a été montrée par rapport au placebo notamment sur les critères de jugement du temps de sommeil total subjectif évalué par le patient à 4 et 12 semaines de traitement et sur la réduction de latence d’endormissement. La supériorité du daridorexant 50 mg a également été notée sur la diminution de la somnolence diurne. Ces résultats ont été retrouvés dans une autre étude visant à évaluer la sécurité à long terme du daridorexant (52 semaines) (2).
Les études préliminaires suggèrent un profil de sécurité plutôt rassurant. Selon le RCP, les effets indésirables les plus fréquemment rapportés incluent les hallucinations, les céphalées, la somnolence, les sensations vertigineuses, les paralysies du sommeil, les nausées et la fatigue. Toutefois, une étude récente des données de la base FAERS révèle de nouveaux effets indésirables potentiels, tels que des symptômes psychiatriques liés au sommeil, notamment les cauchemars, mais aussi la dépression et les idées suicidaires. Dans la base internationale de pharmacovigilance VigiBase, près de 50 % des effets indésirables signalés sont des affections psychiatriques, avec des perturbations du sommeil telles que les cauchemars, l'insomnie ou les rêves anormaux. Il est important de confirmer ces résultats par des études complémentaires mais également de faire preuve de vigilance lors de la prescription du daridorexant, notamment dans les contextes cliniques psychiatriques.
1 Mignot E., Maylebn D., Fietze I., et al. Safety and efficacy of daridorexant in patients with insomnia disorder: results from two multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Neurol. 2022;21(2):125-139.
2 Kunz D., Dauvilliers Y., Benes H., et al. Long-Term Safety and Tolerability of Daridorexant in Patients with Insomnia Disorder. CNS Drugs. 2023;37(1):93-106.
3 Wang Q, Zhou Q, Du Z, Lu R, Jiang Y, Zhu H. Clinical safety of daridorexant in insomnia treatment: Analysis of FDA adverse event reports. J Affect Disord. 2024 Oct 1;362:552-559. doi: 10.1016/j.jad.2024.07.034. Epub 2024 Jul 15. PMID: 39019232.
Un mauvais goût dans la bouche ? Aux origines du nirmatrelvir-ritonavir Paxlovid®
Ema Alves (étudiante), François Montastruc (Toulouse)
Mars 2020, l'épidémie de Covid-19 est déclarée pandémie par l'OMS. Les équipes de la firme Pfizer se lancent alors dans la mise au point d’un médicament pour lutter contre la COVID-19. Ils trouveront le nirmatrelvir-ritonavir, un antiviral inhibiteur du site actif de la protéase 3CL principale du coronavirus. Le médicament sera commercialisé en 2022. Parmi ses effets indésirables, le plus rapporté est la dysgueusie.
La découverte de ce médicament n’est pas un hasard (ou un “un cygne noir” voir autre article du BIP). La firme s’appuie sur son expérience et ses ressources en termes de candidat-médicament. Il faut remonter d’une vingtaine d’années en arrière pour comprendre l’origine du nirmatrelvir. Dans les années 1995-2000, Pfizer développe un antiviral visant les rhinovirus impliqués dans le rhume. Il s’agit du rupintrivir, un médicament inhibiteur de la protéase 3C du rhinovirus. La firme arrête le développement de ce médicament suite aux résultats des essais cliniques de phase II peu concluants chez les patients infectés. Parmi les événements indésirables notables observés pendant ces essais cliniques, on retrouve en particulier des dysgueusies chez environ 25% des volontaires traités par le rupintrivir, versus 12,5% chez les volontaires traités par placebo.
En 2002, en Asie, une épidémie de SRAS (syndrome respiratoire aigu sévère) apparaît ; elle est due à un coronavirus, SARS-CoV-1. Le rupintrivir est utilisé comme base pour développer le lufotrelvir, un pro-médicament inhibiteur de la protéase 3CL du SARS-CoV-1.
En mars 2020 donc, l’équipe de Dafydd Owen de Pfizer s’inspire du lufotrelvir pour développer le nirmatrelvir contre le virus de la COVID-19. En effet, les séquences de la protéase 3CL des coronavirus de 2002 et de 2020 sont quasi-identiques. Le lufotrelvir administré par voie IV est donc un candidat idéal. Owen et son équipe souhaitent développer un médicament par voie orale pour améliorer la praticité d’utilisation du médicament. L’équipe a donc testé plusieurs modifications chimiques, qui ont consisté à éliminer des liaisons hydrogènes favorisant le caractère polaire du médicament l’empêchant ainsi de traverser la barrière intestinale, sans pour autant en perdre l’activité antivirale. Owen arrive au candidat final, le nirmatrelvir, qui possède une biodisponibilité orale satisfaisante. Pour prolonger l’action du médicament, le nirmatrelvir est combiné avec le ritonavir, un inhibiteur enzymatique (« booster ») qui ralentit le métabolisme hépatique du nirmatrelvir. Dans l’essai clinique EPIC-HR randomisé, en double aveugle, contrôlé par placebo, l’association nirmatrelvir-ritonavir va démontrer son efficacité dans le traitement des adultes symptomatiques non hospitalisés infectés par le SARS-CoV-2, non vaccinés et ayant un facteur de risque d’évolution vers une maladie grave.
Enfin, pour favoriser la « vente du produit », il faut trouver un nom commercial au médicament capable de véhiculer une image positive et rassurante. Pour les puissantes équipes marketing de la firme, cela sera Paxlovid® ou PAX-LOVE-COVID, « Paix, amour et Covid ». En conclusion, cet exemple montre finalement que les médicaments trouvent parfois leur origine dans des ébauches-médicaments étudiées des années en amont, parfois même pour d’autres pathologies. Ainsi, on comprend que certains effets indésirables perdurent entre les différentes générations d’une même famille pharmacologique, comme ici la dysgueusie.
Refus de l’autorisation de mise sur le marché du lécanémab (LEQEMBI®), l’EMA résiste.
Romain Barus (Toulouse)
Le comité des médicaments à usage humain (CHMP) de l’Agence européenne des médicaments (EMA) a recommandé, le 25 juillet 2024, le refus de l’autorisation de mise sur le marché du lécanémab (LEQEMBI®) dans la prise en charge des patients atteints de troubles cognitifs légers dus à la maladie d’Alzheimer et aux premiers stades de la maladie d’Alzheimer [1]. Il s’agit du second refus d’un anticorps de cette classe (après le refus en décembre 2021 de l’autorisation de mise sur le marché de l’aducanumab) par l’EMA.
Le lécanémab, tout comme l’aducanumab, est un anticorps dirigé contre les formes agrégées solubles et insolubles du peptide béta-amyloide. En diminuant la formation de plaques amyloïdes, ces anticorps s’attaquent à la pierre angulaire de l’hypothèse amyloïde de la maladie d’Alzheimer. Le lécanémab est présenté par les firmes (Esai et Biogen) comme un « disease-modifier », la réduction des plaques amyloïdes pourrait ralentir le déclin cognitif et ainsi modifier l’histoire naturelle de la maladie d’Alzheimer.
Les firmes ont présenté au CHMP les résultats de l’étude principale portant sur 1 795 personnes atteintes de la maladie d'Alzheimer à un stade précoce, présentant des plaques bêta-amyloïdes et ayant reçu le lécanémab (10mg/kg toutes les 2 semaines) ou le placebo [2]. Le critère principal d'efficacité était le changement des symptômes après 18 mois, mesuré à l'aide d'une échelle d'évaluation de la démence connue sous le nom de CDR-SB (cette échelle permet d’évaluer la gravité de la maladie d'Alzheimer chez les patients et va de 0 à 18, les scores les plus élevés indiquant une déficience plus importante). Après 18 mois, le score CDR-SB des patients traités par lécanémab a augmenté de 1,21 contre 1,66 pour le groupe placebo (différence, -0,45 IC95% [-0,67 à -0,23]). Compte tenu de ce résultat, le CHMP a estimé que l'effet observé de lécanemab sur le retardement du déclin cognitif ne contrebalançait pas le risque d'effets indésirables graves associés au médicament.
Tout comme l’aducanumab, le lécanémab augmente la fréquence de survenue d'anomalies d'imagerie liées à l'amyloïde (ARIA) impliquant un œdème cérébral (ARIA-E) ou des hémorragies cérébrales (ARIA-H). Certains cas d’ARIA étaient graves et ont nécessité une hospitalisation. De plus, le risque d'ARIA était plus prononcé chez les participants ayant le gène ApoE4 et notamment les participants homozygotes en ApoE4 (1/3 d’entre eux ont présenté des ARIA). Par ailleurs, les patients homozygotes en ApoE4 sont plus à risque de développer la maladie d'Alzheimer.
A noter, un troisième anticorps qui cible la forme pyroglutamate du béta-amyloïde, devrait être évalué par l’EMA, il s’agit du donanémab de la firme Lilly qui vient d’être approuvé en juillet 2024 par la Food and Drug Administration aux Etats-Unis et présente un profil de risque similaire à ses prédécesseurs [3].
1. https://www.ema.europa.eu/en/medicines/human/EPAR/leqembi
2. Dyck CH van, Swanson CJ, Aisen P, et al (2023) Lecanemab in Early Alzheimer’s Disease. New England Journal of Medicine 388:9–21. https://doi.org/10.1056/NEJMoa2212948
3. https://www.fda.gov/drugs/news-events-human-drugs/fda-approves-treatment-adults-alzheimers-disease
Alopécie médicamenteuse
Sawsan EL HUSSEIN (Montpellier)
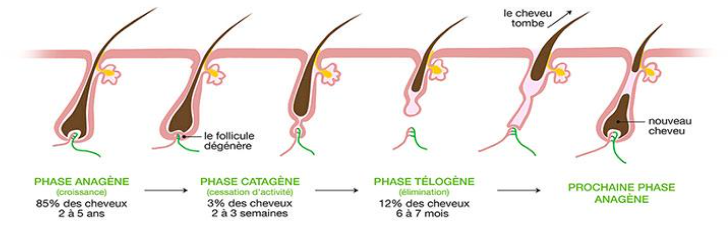
Le cycle de vie d'un cheveu comprend quatre phases principales : anagène, catagène, télogène et la kénogène (dormance du bulbe, précédant une nouvelle phase anagène). Un follicule subit en moyenne 25 à 30 cycles au cours d'une vie, avec une chute normale de 50 à 100 cheveux par jour compensée par la repousse (1,2). Cependant, certains facteurs comme l'âge, les hormones, la génétique et les médicaments peuvent perturber ce cycle.
La chute de cheveux iatrogène, peut se manifester de différentes manières (1-4) :
1. L'effluvium anagène, avec une chute brutale et massive de cheveux, généralement quelques jours à quelques semaines après le début du traitement. Le médicament arrête brusquement le développement du cheveu en phase d’anagène, provoquant sa chute prématurée. C'est le cas avec les chimiothérapies.
2. L'effluvium télogène, avec une chute diffuse et modérée (moins de 50% de la chevelure), survenant 2 à 4 mois après le début du traitement. Le médicament synchronise de façon anormale l'entrée des cheveux en phase de télogène. C’est le cas avec les antirétroviraux, les anticorps monoclonaux et les inhibiteurs de protéine kinase.
4. L'alopécie aerata est une maladie auto-immune dans laquelle le système immunitaire attaque les follicules pileux par erreur. Certains médicaments, en particulier les immunosuppresseurs et les modulateurs hormonaux, peuvent perturber le système immunitaire, déclenchant potentiellement une réaction auto-immune contre les follicules pileux. C’est le cas avec certains traitements ciblant les cytokines impliquées dans la réponse immunitaire, comme les anticorps monoclonaux anti-TNFα (infliximab) et anti-interleukine 4 (dupilumab), ainsi que les inhibiteurs de checkpoint immunitaire
3. L’alopécie androgénétique où certains médicaments androgéniques (contraceptifs oraux, les traitements hormonaux de la ménopause) peuvent déclencher ou aggraver une chute de cheveux chez les personnes prédisposées, en rétrécissant progressivement les follicules pileux sensibles aux androgènes.
Un diagnostic approfondi est recommandé pour identifier la cause précise de l'alopécie et adapter si possible le traitement en cause. Dans la plupart des cas, l'alopécie médicamenteuse est réversible à l'arrêt du traitement, mais peut récidiver en cas de reprise. Une surveillance étroite et une information des patients sur ce risque restent essentielles pour une meilleure prise en charge.
Références :
1 Stanislas Quesada, Alexandre Guichard, Sarah Le Vigouroux, Louise Baussard, Frédéric Fiteni, Alopécie et cancers : de la physiopathologie à la pratique clinique, Bulletin du Cancer, Volume 108, Issue 10, 2021, Pages 963-980, ISSN 0007-4551, https://doi.org/10.1016/j.bulcan.2021.04.011
2 Sachse MM, Kähler KC. Alopezie durch Chemotherapeutika, Hedgehog-Inhibitoren, zielgerichtete Antikörpertherapien und Immuncheckpointinhibitoren : Pathogenese, Klinik, Diagnostik und Prophylaxe [Alopecia due to chemotherapeutics, hedgehog inhibitors, targeted antibody therapies and immune checkpoint inhibitors : Pathogenesis, clinical picture, diagnostics and prophylaxis]. Dermatologie (Heidelb). 2024 May 23. German. doi: 10.1007/s00105-024-05352-5. Epub ahead of print. PMID: 38780777.
3 Alhanshali L, Buontempo M, Shapiro J, Lo Sicco K. Medication-induced hair loss: An update. J Am Acad Dermatol. 2023 Aug;89(2S):S20-S28. doi: 10.1016/j.jaad.2023.04.022. PMID: 37591561.
4 François Pillon, Les alopécies médicamenteuses, transitoires mais invalidantes, Actualités Pharmaceutiques, Volume 52, Issue 522, 2013, Pages 46-47, ISSN 0515-3700, https://doi.org/10.1016/j.actpha.2012.11.009.
Lithium et diabète Insipide : un effet indésirable fréquent à ne pas sous-estimer
Véronique Pinzani (Montpellier)
Les sels de lithium constituent le traitement thymorégulateur de première intention dans les troubles bipolaires (Service médical rendu important).
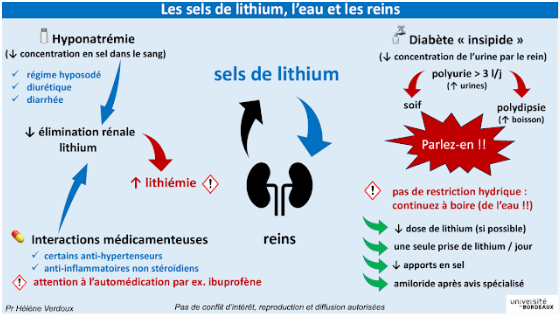
Le lithium se comporte comme un ion dans l’organisme. Il est filtré au niveau des glomérules et réabsorbé majoritairement dans le tube proximal (80%) mais aussi dans une plus petite proportion dans le tube collecteur via le canal sodique. L’intervalle thérapeutique du lithium est étroit et se situe entre 0,6 et 1,2 mmol/l (taux résiduel). La lithiémie est directement influencée par le taux de filtration glomérulaire et le degré de réabsorption tubulaire.
Parmi les effets indésirables du lithium, on note une atteinte possible de la fonction rénale surtout à type de diabète insipide néphrogénique et de syndrome néphrotique. Le diabète insipide est défini par une incapacité à retenir de l’eau libre et est dû soit à une libération insuffisante d’hormone antidiurétique (c’est le diabète insipide central), soit à une résistance du rein à l’ADH (c’est le diabète insipide néphrogénique, DIN). La concentration urinaire étant défaillante, le patient présente une polyurie et une hypernatrémie (si les apports en eau sont insuffisants). Cet effet indésirable se rencontre chez 20 % à 40 % patients et parfois très rapidement (dès les premières semaines). Lorsqu’un DIN est diagnostiqué, l’arrêt du lithium doit être envisagé si possible. Le schéma ci-dessous du Pr Verdoux résume cette problématique du lithium au niveau rénal.
En France, 104 notifications de DIN sous lithium ont été enregistrées avec une majorité de femmes (68,3%). Ces notifications ont été considérées comme grave dans 74% des cas (source VigiBase au 23/05/2024).
Après arrêt du lithium, le DIN peut persister durant plusieurs mois en raison de l’accumulation intracellulaire de lithium et plus rarement il peut être irréversible. Un traitement par amiloride ou diurétique thiazidique permet parfois d’améliorer ce DIN.
En conclusion, il convient de bien surveiller la créatinine lors de l’introduction d’un traitement de lithium, deux à trois fois pendant les six premiers mois puis annuellement afin de détecter toute altération de la fonction rénale.
P Felix, C Stoermann-Chopard, PY Martin. Lithium et atteintes rénales chroniques : un sujet toujours d’actualité. Revue Médicale Suisse 2010 ;6 :448-52.
A Servais Néphrotoxicité du lithium. La Revue du Praticien Médecine Générale. 2018,32(995) :116
RISQUE ACCRU D'UVÉITE NON INFECTIEUSE AVEC LES INHIBITEURS DE BRAF CHEZ LES PATIENTS ATTEINTS DE MÉLANOME OU DE CANCER DU POUMON
Clémence Jutard (interne), Virginie Bres et Jean-Luc Faillie (Montpellier)
Les inhibiteurs de BRAF, tels que le vemurafenib et le dabrafenib, ciblent les mutations activatrices du gène BRAF impliquées dans la prolifération cellulaire tumorale du mélanome et d'autres cancers.
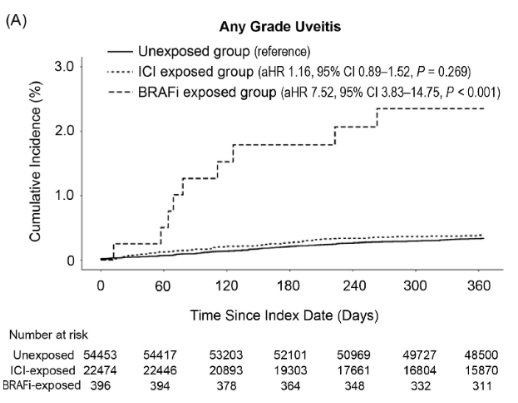
Une récente étude de cohorte a comparé l'incidence de l'uvéite non infectieuse chez les patients traités pour mélanome cutané ou cancer du poumon en utilisant la base de données du système d'assurance maladie national en Corée du Sud entre 2011 et 2022. Un total de 77 323 patients a été inclus et classé en trois groupes : traités par des agents cytotoxiques conventionnels (n=54 453), exposés aux inhibiteurs de BRAF (n=396), et exposés aux inhibiteurs de points de contrôle immunitaire (ICIs) (n=22 474).
L'incidence cumulative de l'uvéite au cours de la première année était de 2,27 % chez les patients sous inhibiteurs de BRAF, comparée à 0,35 % et 0,33 % chez ceux traités par ICIs ou par chimiothérapie. Après appariement sur score de propension, les Hazards Ratio ajustés (aHR) ont montré un risque 35,51 fois plus élevé pour l'uvéite et 15,80 fois plus élevé pour l'uvéite sévère chez les patients exposés aux inhibiteurs de BRAF par rapport à ceux sous chimiothérapie conventionnelle. La majorité des cas d’uvéite ont eu lieu dans les 160 premiers jours de traitement par inhibiteurs de BRAF. Dans une analyse additionnelle en cross-over, une méthode d'autocontrôle où chaque patient traité par inhibiteurs de BRAF est son propre témoin, le risque d'uvéite augmentait de 3,71 fois pendant l'année suivant le début du traitement par rapport à l'année précédant le traitement. Elle a également révélé que, dans le groupe traité par inhibiteurs de BRAF, le sexe féminin, la présence de maladie rénale chronique, et le diagnostic de mélanome étaient associés à une tendance vers un risque plus élevé d'uvéite, bien que ces associations n'aient pas atteint un niveau de signification statistique. Cette étude présente toutefois certaines limites, notamment liées à l’utilisation de données issues des demandes de remboursement (sous-types d’uvéite non identifiés, non inclusion des patients des essais cliniques). De plus, 94.7% des patients traités par inhibiteurs de BRAF recevaient l’association dabrafenib + trametinib, et l’impact du trametinib sur la survenue d’une uvéite n’a pas pu être évalué car il n’est pas remboursé en monothérapie dans ce pays.
En conclusion, cette étude indique un sur-risque d’uvéite non infectieuse chez les patients atteints de mélanome ou de cancer du poumon traités avec des inhibiteurs de BRAF et souligne l'importance de l'éducation des patients avant le traitement et d’une surveillance ophtalmologique régulière pour prévenir des complications graves.
Prise en charge pharmacologique de la douleur (non neuropathique) chez la femme enceinte
Marie-Andrée Thompson-Bos, Cosette Le Souder (Montpellier)
La gestion pharmacologique de la douleur chez la femme enceinte est une situation fréquente dans laquelle les médecins généralistes et les pharmaciens d’officine jouent un rôle clef.
Le paracétamol demeure le traitement de première intention, quel que soit le terme, pour une douleur légère à modérée. Il est largement reconnu pour son profil de sécurité favorable lorsqu'il est utilisé conformément aux doses et durées recommandées. Parmi les antalgiques opiacés, la codéine est préférable au tramadol car il s’agit d’un médicament plus ancien et non doté d’activité noradrénergique et sérotoninergique. Et, pour des douleurs très intenses, la morphine est une option envisageable, quel que soit le terme de la grossesse, en respectant les précautions habituelles (posologie minimale efficace et traitement le plus court possible). Pour ces antalgiques opiacés, en cas de traitement proche du terme, l’équipe de la maternité devra être parfaitement informée du traitement maternel (posologie, durée de traitement) pour se préparer à la prise en charge éventuelle de manifestations néonatales transitoires (d’imprégnation, avec détresse respiratoire, hypoglycémie et/ou de sevrage).
Concernant les douleurs inflammatoires, on évite les AINS au premier semestre (en raison d’un doute sur une légère augmentation du risque de fausse couche). Puis, dès 12 semaines d’aménorrhée (SA), le rein fœtal devient fonctionnel, les prises prolongées sont limitées ; en effet, les AINS peuvent être responsables de toxicité fœtale et/ou néonatale rénale et cardiovasculaire (notamment fermeture prématurée du canal artériel). A partir de 24 SA, il est important de rappeler à la femme enceinte la contre-indication absolue de tous les AINS, même en prise ponctuelle. Plus le terme est avancé, plus le risque est élevé. Lorsqu’ils sont indiqués, l’utilisation des corticoïdes peut en revanche être envisagée quel que soit le terme, en privilégiant la prednisone et la prednisolone. Si le traitement est prolongé, il conviendra de surveiller le poids, la tension artérielle, et d’être vigilant quant à l’augmentation du risque d’infection chez la femme enceinte. Également, si le traitement se prolonge jusqu’au terme, une surveillance clinique et biologique du nouveau-né est à discuter.
Enfin, il est important de rappeler que si la douleur nécessite une exploration, aucun examen d’imagerie médicale usuel n’est contre-indiqué durant la grossesse, et ce, quel que soit le terme.
Exposition aux IPP pendant la petite enfance et risque d’asthme
Justine Bénévent (Toulouse)
Les médicaments des troubles liés à l’acidité sont largement utilisés pour le traitement du reflux gastro-œsophagien (RGO), tant chez les femmes enceintes que chez les enfants. Cependant, des interrogations émergent quant à leurs effets à long terme après une exposition prénatale ou durant l'enfance, notamment en ce qui concerne le risque accru de développer des pathologies allergiques telles que l'asthme. En effet, la dysbiose intestinale ainsi que la perturbation de la digestion des antigènes induites par ces médicaments, pourraient entraîner une sensibilisation du système immunitaire, favorisant ainsi l'apparition de maladies allergiques.
Nous avons mené une étude pour évaluer l'association entre l'exposition précoce à ces médicaments et la survenue d'asthme pendant l'enfance. Cette étude a été conduite au sein de la cohorte POMME, qui inclut les enfants nés en Haute-Garonne en 2010 et 2015. Pour ces enfants, nous disposons de données sur les prescriptions et les remboursements de médicaments depuis leur conception jusqu'en 2022 (soit jusqu'à l'âge de 12 ans pour ceux nés en 2010, et jusqu'à l'âge de 7 ans pour ceux nés en 2015).
Le risque d'asthme a été évalué en comparant le nombre d'enfants identifiés comme asthmatiques parmi ceux exposés aux IPP et/ou anti-H2 durant la période de vie précoce (in utero et petite enfance [0-2 ans]), à deux groupes témoins : les enfants exposés aux acides alginiques (comparateur actif, ne modifiant pas le pH gastrique) et les enfants non exposés aux médicaments anti-acides.
Les résultats de cette étude suggèrent une association entre l'exposition précoce aux IPP et anti-H2 et l'apparition de l'asthme dans l'enfance. Au sein de cette période de vie précoce, nos résultats indiquent que la fenêtre d’exposition à risque était l’enfance (RRajusté : 1,43 [1,18 ; 1,74]). L'utilisation d'un comparateur actif pour contrôler le biais d'indication a permis d’obtenir des résultats rassurants quant à l’utilisation des IPP et anti-H2 durant la grossesse (RRajusté : 1,12 [0,94 ; 1,33]). Notre étude ajoute un argument supplémentaire aux risques d’effets à long terme des IPP utilisés chez les enfants. Ces médicaments doivent donc être prescrits avec précaution dans cette population.
L'influence des industriels sur les prescriptions : quels enjeux et quelles solutions ?
Jean-Luc FAILLIE (Montpellier)
Les professionnels de santé sont régulièrement exposés à la promotion des représentants de l'industrie pharmaceutique. Une revue systématique menée par la Haute Autorité de Santé (HAS) a analysé près de 200 études internationales pour évaluer l’influence de cette promotion sur les prescriptions (1).
Il en ressort que le démarchage, sous forme de visites individuelles, conférences, et contacts lors de congrès, reste une méthode de promotion clé. Les interactions promotionnelles sont omniprésentes, touchant autant les professionnels en exercice que les étudiants en santé, avec une information souvent biaisée, favorisant les messages sur l'efficacité des produits tout en minimisant les risques associés. La HAS montre que cette pratique a un impact réel sur la prescription des médecins, bien que ces derniers sous-estiment cette influence sur eux-mêmes, tout en la reconnaissant chez leurs pairs.
Pour illustrer ce phénomène, une étude menée par Goupil et al., publiée dans le BMJ en 2019, explorait l'impact des rétributions financières des laboratoires pharmaceutiques sur les prescriptions médicales en France (2). En utilisant la base de données de transparence et celle de l'Assurance Maladie, les chercheurs ont analysé la relation entre le montant des cadeaux reçus par les médecins et leur « performance » de prescription, évaluée selon 11 critères. Les résultats montrent que les médecins ayant reçu plus de 1000 € en cadeaux dans l’année ont un coût moyen de médicaments remboursés par consultation de 53,2 €, contre 45,8 € pour ceux n'ayant reçu aucun cadeau. Un autre critère, le taux de prescription de génériques de statines est également plus faible chez les médecins récipiendaires (65,3 % contre 77,6 %). De plus, un effet dose est observé, où la « qualité » des prescriptions diminue à mesure que le montant des cadeaux augmente. Notamment, même de petits cadeaux (10 à 69 €) influencent significativement les pratiques de prescription, soulignant les mécanismes sociaux de redevabilité.
Pour limiter l'influence de l'industrie sur les prescriptions médicales, la HAS recommande des interventions politiques et institutionnelles strictes, telles que des lois restrictives et une gestion rigoureuse des relations entre professionnels de santé et industriels, assorties de suivi et de sanctions bien que le système de régulation français n'ait pas encore démontré une efficacité supérieure à celle des autres pays. La formation des étudiants à l'analyse critique de l'information promotionnelle est également cruciale pour renforcer leur vigilance face aux techniques de marketing pharmaceutique, bien que progressivement intégrée dans nos facultés, elle demeure encore insuffisante. Enfin, la HAS encourage une réflexion sur le financement indépendant des formations et congrès pour préserver l'intégrité des pratiques médicales.
Bien que les pratiques aient beaucoup évolué au cours des dernières décennies, il faut encore lutter contre l'influence de la promotion pharmaceutique sur la prescription, une influence bien documentée mais souvent sous-estimée par les professionnels de santé eux-mêmes.
1 HAS. Interactions des professionnels de santé avec les représentants de l’industrie. Décembre 2022. www.has-sante.fr/upload/docs/application/pdf/2022-12/has_090_synthese_revue_info_promo_cd_20221208_vf.pdf
Inhibiteurs de la Pompe à Protons et prescription inappropriée : quelle solution envisager
Haleh Bagheri (Toulouse)
Depuis plus d’une dizaine d’années, des études sont régulièrement publiées sur la prescription inappropriée des IPP (jusqu’à 70%), quant à leur indication, leur dose et/ou la durée de prescription. Des recommandations sont publiées par les autorités sanitaires (Agence Nationale de Sécurité du Médicament, Haute Autorité de Santé...). Entre 2010 et 2015, les ventes des IPP a augmenté de 27% en France atteignant 85 millions boîtes en 2015 (1). L’Assurance maladie, consacrant des milliers d’euros annuels pour le remboursement des IPP, a mis à jour récemment (juin 2024) les recommandations sur les IPP (2). D’autres études suggèrent le risque d’effets indésirables lors d’exposition au long cours (anémie, hypomagnésémie, voire démence). Souvent, les publications sur le risque des IPP concluent avec la nécessité d’études supplémentaires pour élucider le lien de causalité entre IPP et effets indésirables... Mais rares sont les papiers insistant sur les bases simples de physiologie/pharmacologie, sur le fait que l’acidité gastrique peut avoir des effets bénéfiques et que sa neutralisation au long cours entraîne des effets graves comme le cancer gastrique (3). Des logiciels existent pour aider les prescripteurs à la déprescription des IPP mais le mésusage des IPP reste planétaire. Que faut-il faire pour réduire le mésusage des IPP? Le ministère de la santé et des services sociaux de Québec a trouvé une solution partielle en limitant le remboursement des IPP à un maximum de 90 jours (4). Après les multiples rappels sur le respect des règles de prescription des IPP et le mésusage continu de ces derniers malgré des tentatives d’améliorations des professionnels de santé, une des solutions pourrait être de limiter la durée de prescription des IPP sauf pour des cas particuliers (comme par exemple le Zollinger-Elison).
1.https://www.epi-phare.fr/app/uploads/2020/04/EPI-PHARE_2018_utilisation_IPP.pdf
3.Charpiat B. Prescr.2024, 44 (491), 713-14
4. www.ramq.gouv.qc.ca/sites/default/files/documents/non_indexes/papillon_ipp_fr.pdf
Le cygne noir et la pharmacovigilance
Yannis Routier (étudiant), François Montastruc (Toulouse)
En philosophie, les événements à fort impact sociétal, politique, économique et impossibles à prévoir sont appelés « cygnes noirs ». Les explications sur l’apparition des « cygnes noirs » sont données a posteriori, rendant le fait explicable et prévisible (distorsion rétrospective). Cette idée a été théorisée par l’économiste et statisticien Nassim Nicholas Taleb dans son best-seller Le Cygne noir : La puissance de l'imprévisible qui souligne le rôle massif des évènements rares. L'expression « cygne noir » était utilisé comme une déclaration d'impossibilité : « rara avis in terris nigroque simillima cygno »*. En effet, les européens pensaient que tous les cygnes étaient de couleur blanche puisqu’ils n’en avaient jamais vu d’une autre couleur… jusqu’en 1697 où des expéditeurs néerlandais ont découvert en Australie des cygnes de couleur noire . Cette découverte a déconstruit une connaissance qui était considérée comme irréfutable pendant plusieurs années.
L’histoire de la pharmacovigilance est marquée par les cygnes noirs, c’est-à-dire la découverte d’effets indésirables rares, inattendus avec un fort impact sociétal et/ou médical. Récemment, on peut citer l’impact majeur sur la politique vaccinale des cas de thromboses atypiques déterminé par le vaccin anti-COVID-19 d’AstraZeneca. Ces thromboses atypiques graves ont modifié la campagne de vaccination en faveur des vaccins anti-COVID-19 à ARNm. L’effet indésirable était non prévisible (mécanisme inconnu) et ne pouvait pas être mis en évidence dans les essais cliniques car trop rare.
Un des objectifs de la pharmacovigilance est d’être performant dans la détection et la prévention de ces épisodes peu courants ayant un fort impact clinique. Nous insistons donc sur l’importance de déclarer à votre CPRV tout effet indésirable inattendu et/ou « grave » possiblement en lien avec l’utilisation d’un médicament.
Pour aller plus loi et participez à la chasse aux cygnes noirs, blancs et gris dans le monde passionnant de la pharmacovigilance, c’est ici https://www.drugsafetymatterspod.org/618871/14599616-28-catching-black-swans-francois-montastruc
*« un oiseau rare dans le pays, rare comme un cygne noir »
Actualité estivale en addictovigilance inscription sur la liste des stupéfiants des « Nitazènes », nouveaux opioïdes de synthèse
Céline Eiden, Hélène Peyrière, Montpellier
Le 05/07/2024, l’ANSM a pris la décision d’inscrire sur la liste des stupéfiants une nouvelle classe d’opioïdes de synthèse dénommés « nitazènes », suite à plusieurs signalements d’événements graves depuis mars 2023 sur le territoire Français.
Le processus national de classement d'une substance donnée se base sur les éléments d'appréciation élaborés par l'OMS ainsi que sur les données fournies par la vigilance nationale dédiée à la surveillance de l’abus et de la pharmacodépendance : l’addictovigilance.
Les nitazènes et dérivés présentent une structure chimique commune de type benzimidazole, et sont aussi désignés sous le terme de “dérivés benzimidazolés”. La plupart des représentants de cette classe de substances sont plus puissants que la morphine et équivalents ou légèrement supérieurs au fentanyl. Particulièrement dangereuses, ces molécules sont associées à un risque élevé de surdose potentiellement mortelle, même à faible dose. Le risque de dépendance est également plus important. Deux décès ont été rapportés en France.
De manière préventive, dans le cadre de la réduction des risques liée à l’usage d’opioïdes, il est recommandé pour les usagers et/ou leur entourage d’avoir à disposition un ou plusieurs kits de naloxone, qui est l’antidote en cas d’overdose. La dose nécessaire de naloxone à utiliser peut-être toutefois supérieure à celle administrée pour d’autres opioïdes.
Les nitazènes ne sont pas détectables par un dépistage urinaire classique (immunochimie ou criblage chromatographique de première intention). Il faut utiliser des techniques séparatives chromatographiques adaptées.
Toute discordance entre les symptômes et les analyses biologiques et/ou la réponse à l’administration de naloxone doit faire évoquer la présence d’un opioïde de synthèse : devant une overdose supposée aux opioïdes, avec négativité des analyses toxicologiques de première intention, ou devant une overdose supposée aux opioïdes avec positivité du dépistage aux opiacés mais résistant à l’administration de doses usuelles de naloxone.
En cas de doute sur une consommation de nitazènes, il faut contacter le centre d’addictovigilance de la région concernée afin d’investiguer rapidement la consommation ou pas de ces opioïdes de synthèse : analyse toxicologique ciblée, éventuellement analyse de la substance via un laboratoire de toxicologie ou le dispositif Sintes.
Effet de l’aripiprazole sur la biosynthèse du cholestérol et questionnement sur un éventuel risque tératogène
Fatma Ben Hadj Hassine, Thierry Levade, Adeline Jullien, Grégoire Benvegnu, Célia Bettiol, Antoine Yrondi, Thomas Lanot (Toulouse)
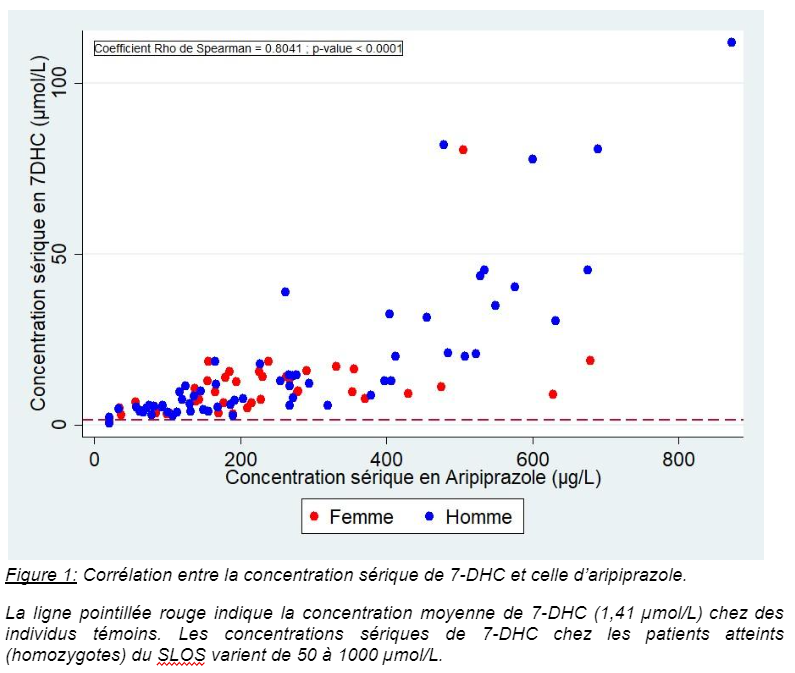
L'aripiprazole est un antipsychotique communément utilisé pour traiter schizophrénies et troubles bipolaires, y compris chez la femme enceinte. Quelques études ont récemment rapporté une augmentation de la concentration circulante de 7-déhydrocholestérol (7-DHC) chez des patients sous aripiprazole ou halopéridol1,2 comme on l’observe dans le syndrome de Smith-Lemli-Opitz (SLOS). Cette pathologie génétique, caractérisée par un tableau malformatif et un retard neurodéveloppemental, est due à une accumulation de 7-DHC consécutive au déficit de l'activité de l'enzyme 7-déhydrocholestérol réductase (DHCR7). Cette enzyme, qui est inhibée par l'aripiprazole ou l’halopéridol, est la dernière étape de la biosynthèse du cholestérol. Ces antipsychotiques peuvent pénétrer le cerveau fœtal et augmentent les taux de 7-DHC chez les souriceaux dont la mère a été traitée, d’autant plus que ces derniers et/ou leur mère sont hétérozygotes pour le SLOS3. Notre étude, menée chez une centaine de patients traités par aripiprazole, met en évidence une élévation des concentrations sériques de 7-DHC qui sont corrélées à celle de l’antipsychotique et à sa posologie (Figure 1). Aucun trouble des stérols n'a été observé chez des patients traités par la clozapine, un autre antipsychotique. Sachant que le 7-DHC et/ou ses dérivés sont potentiellement toxiques et peuvent altérer le développement embryonnaire, est soulevée la question d’un possible effet tératogène des antipsychotiques inhibant la DHCR74, même si les données actuellement disponibles ne mettent pas en évidence d’augmentation du risque malformatif lors d’une exposition en cours de grossesse.
Références :
1. Hall P, Michels V, Gavrilov D, et al. Aripiprazole and trazodone cause elevations of 7-dehydrocholesterol in the absence of Smith–Lemli–Opitz Syndrome. Mol Genet Metab. 2013;110(1-2):176-178. doi:10.1016/j.ymgme.2013.04.004
2. Korade Ž, Liu W, Warren EB, Armstrong K, Porter NA, Konradi C. Effect of psychotropic drug treatment on sterol metabolism. Schizophr Res. 2017;187:74-81. doi:10.1016/j.schres.2017.02.001
3. Genaro-Mattos TC, Allen LB, Anderson A, et al. Maternal aripiprazole exposure interacts with 7-dehydrocholesterol reductase mutations and alters embryonic neurodevelopment. Mol Psychiatry. 2019;24(4):491-500. doi:10.1038/s41380-019-0368-6
4. Boland MR, Tatonetti NP. Investigation of 7-dehydrocholesterol reductase pathway to elucidate off-target prenatal effects of pharmaceuticals: a systematic review. Pharmacogenomics J. 2016;16(5):411-429. doi:10.1038/tpj.2016.48
Autobrasserie vésicale sous gliflozine
Jean-Joseph BENDJILALI-SABIANI (interne), Yoann CAZAUBON (Montpellier)
La fermentation d’alcool par les levures, notamment Saccharomyces cerevisae, est un processus parfaitement connu et une production endogène d’éthanol peut se produire au niveau intestinal ce qui engendre des intoxications à l’éthanol. En revanche, une production d’éthanol au niveau vésical est moins connue et a été décrite pour la première par Kruckenberg et al. en 2020 [1].
Nous rapportons le cas d’un patient de 68 ans hospitalisé en hémato-oncologie pour une thrombopénie. Durant le séjour, l’équipe soignante retrouve des canettes de bières dans la poubelle du patient, motivant une prescription d’un dosage d’éthanol dans les urines et le plasma. L’éthanolémie est négative mais l’éthanolurie est positive. Entre-temps le patient est admis en réanimation pour un arrêt cardio-respiratoire. La prescription d’éthanolémie/urie est reconduite constatant toujours cette discordance. Devant une candidurie à Candida dubliniensis et Candida parapsolosis, un diagnostic d’autobrasserie est évoqué. Au-delà de l’éthanol, la fermentation alcoolique peut aussi produire du méthanol, un dosage urinaire est réalisé révélant une concentration de 2,33 g/L d’éthanol et 0,96 g/L de méthanol. Le diagnostic d’autobrasserie est par la suite confirmé par une mise à l’étuve du culot urinaire de levures pendant 12h à 37°C démontrant une fermentation active : 15 g/L d’éthanol et 1,8 g/L de méthanol sont mesurés. Au niveau plasmatique aucun alcool n’est retrouvé du fait des caractéristiques de l’épithélium vésical, transitionnel, empêchant ainsi une réabsorption au niveau systémique.
La fermentation alcoolique en milieu aérobique ne peut se faire que sous la dépendance de l’effet Crabtree inductible qu’à des concentrations en glucose > 150 mg/L. Le patient, non diabétique, traité par un inhibiteur de SGLT2 (iSGLT2), empagliflozine 10 mg/J, pour la prise en charge d’une insuffisance cardiaque avait une glycosurie mesurée de 11800 mg/L. Afin d’éradiquer ce phénomène, la candidurie a été traitée par 600 mg/j de fluconazole pendant 10 jours. Il semble donc que la prise d’iSGLT2 soit un facteur contributif à une fermentation alcoolique vésicale. Toutefois, chez les insuffisants cardiaques, sa suspension n’est pas recommandée au regard du bénéfice présenté par cette classe thérapeutique. La découverte fortuite de ce phénomène, peu documenté au niveau vésical, pourrait faire l’objet d’une surveillance.
[1] K.M. Kruckenberg, A.F. DiMartini, J.A. Rymer, A.W. Pasculle, K. Tamama, Urinary Auto-brewery Syndrome: A Case Report, Ann Intern Med 172 (2020) 702–704. doi.org/10.7326/L19-0661.

BIP Occitanie fait partie de l'International Society of Drug Bulletins (ISDB)