BIP 2024 N°2

EDITORIAL
Jean-Luc FAILLIE (Montpellier)
Les pénuries de médicaments résultent de divers facteurs comme des problèmes de fabrication ou des fluctuations de la demande. En augmentation constante ces dernières années, elles touchent des médicaments essentiels comme les anti-infectieux, les médicaments cardiovasculaires ou les médicaments du système nerveux. Bien que des mesures de relocalisation de la production soient envisagées, elles n'auront pas d'impact immédiat. De nouvelles mesures sont proposées, notamment la distribution à l'unité de certains médicaments et la réalisation de tests en pharmacie avant la délivrance d'antibiotiques. L'ANSM a également renforcé ses pouvoirs, pouvant imposer des mesures telles que le contingentement, l’obligation de stock de sécurité et des sanctions financières aux laboratoires pharmaceutiques en cas de non-respect des consignes. Ces mesures seront-elles efficaces ?
Les problèmes d’approvisionnement ont pourtant un impact majeur : en premier lieu, une perte de chance pour les patients en raison des arrêts de traitement et des non-initiations, mais aussi un risque d’erreurs médicamenteuses. Par exemple, dans le cas des agonistes GLP-1, des incidents de surdosage ou d'inefficacité ont été signalés suite à des changements entre spécialités utilisant des stylos injecteurs différents ou en cas d'indisponibilité du stylo de la dose prescrite. L'étude CIRUPT menée en France par le réseau des CRPV avait examiné les conséquences iatrogènes des ruptures de stock. Sur les 462 cas signalés entre 2004 et 2019, une tendance croissante a été observée, avec 46,3 % de cas graves (dont 9 décès) et 15,9 % d'aggravation de la maladie due à l'inefficacité du médicament de remplacement. Environ 67% des erreurs se sont produites lors de l'administration du médicament, principalement des erreurs de dosage.
Les professionnels de santé et les patients sont souvent démunis face aux problèmes d’approvisionnement. L'ANSM fournit un tableau mis à jour de la disponibilité des médicaments, tandis que des outils tels que le site quellepharmacie.fr permettent d'estimer les stocks de chaque spécialité dans les pharmacies environnantes.
Sommaire
- INFOS IMPORTANTES - ALERTES
- PHARMACOLOGIE CLINIQUE
- PHARMACOVIGILANCE
- PHARMACO-EPIDEMIOLOGIE
- MEDICAMENTS, REPRODUCTION ET PERINATALITE
- PHARMACOLOGIE SOCIALE
- ADDICTOVIGILANCE
- PHARMACOLOGIE-TOXICOLOGIE

L'ordonnance du mois
À VOUS DE JOUER !
Dr Paul Gautier (interne) et Dr François Montastruc – Toulouse
| Un patient de 79 ans a été hospitalisé 5 jours pour un œdème aigu pulmonaire. Après une déplétion par furosémide, il est sorti d’hospitalisation et vous le revoyez en consultation. Il présente comme antécédents : une cardiopathie ischémique ancienne, une dyslipidémie, une hypertension artérielle, un diabète de type 2, une hypertrophie bénigne de la prostate. |
Son ordonnance est la suivante :
|
Vous souhaitez prescrire à ce patient un inhibiteur du SGLT-2 (« gliflozines ») : empagliflozine ou dapagliflozine pour son insuffisance cardiaque. Quelles sont les précautions que vous devez prendre avant de prescrire ce médicament, et quelles sont les mesures de surveillance à respecter ?
Réponse
Rappel : La dapagliflozine et l’empagliflozine sont des inhibiteurs réversibles du sodium-glucose cotransporteur de type 2. Ils exercent notamment un effet glycosurique et natriurétique au niveau du tubule contourné proximal du rein, et donc des effets diurétique et hypoglycémiant modérés. Ces médicaments ont une indication dans le diabète de type 2, l’insuffisance cardiaque chronique et la maladie rénale chronique. Chez les patients atteints d’une insuffisance cardiaque à fraction d’éjection ventriculaire gauche altérée (< 40%), la dapagliflozine et l’empagliflozine sont associées à une réduction du risque d’hospitalisation pour insuffisance cardiaque et de la mortalité cardiovasculaire (1,2) (SMR important, ASMR IV). Chez les patients atteints d’une insuffisance cardiaque à fraction d’éjection ventriculaire modérément altérée (40-49%) ou préservée (≥ 50%), la dapagliflozine et l’empagliflozine sont asspcoées à une réduction du risque d’hospitalisation pour insuffisance cardiaque (3,4) (SMR important, ASMR IV).
Lors de la prescription d’une gliflozine, il faut surveiller les points suivants (5) :
- L’effet diurétique des gliflozines peut être majoré notamment en cas d’association à d’autres diurétiques ou en cas de glycémie très élevée, et nécessitent donc une surveillance attentive de la pression sanguine artérielle et régulière de la fonction rénale, et une recherche de signes d’hypotension orthostatique ou de déshydratation. Il existe donc un risque d’insuffisance rénale fonctionnelle lors de l’association avec les diurétiques, les inhibiteurs de l’enzyme de conversion (IEC), les antagonistes des récepteurs de l’angiotensine II (« sartans »), les anti-inflammatoires non stéroïdiens (AINS).
- Il existe un risque d’hypoglycémie, qui est modéré en monothérapie mais qui peut être majoré en cas d’association à d’autres médicaments hypoglycémiants.
- Il existe également un risque rare d’acidocétose diabétique, et les signes suivants doivent alerter : nausées et vomissements, douleurs abdominales, fatigue inhabituelle, soif. Leur présence doit conduire à rechercher en urgence une cétonurie ou à doser la cétonémie, y compris en cas de glycémie normale. Cette complication est rare mais peut survenir plus volontiers en cas de déshydratation, de jeûne, de consommation excessive d’alcool, de maladie aiguë ou d’intervention chirurgicale. Il est donc nécessaire d’interrompre temporairement le traitement par gliflozine lors de ces situations à risque.
- Il existe également un risque d’infection urinaire en lien avec l’effet glycosuriant du traitement. Il faut rechercher des signes évocateurs d’infection urinaire comme des douleurs à la miction, une urgenturie, une pollakiurie, des difficultés à uriner. Le traitement par gliflozine doit être interrompu temporairement dans cette situation.
- Enfin, il existe un risque d’infection génitale, et il faut rechercher les signes suivants : douleur, rougeur, tuméfaction des organes génitaux et du périnée. Ces infections présentent un risque rare mais grave d’évolution vers la fasciite nécrosante. Un traitement spécifique (antibiothérapie et débridement chirurgical) doit être initié et le traitement par gliflozine doit être immédiatement interrompu.
1. McMurray JJV, Solomon SD, Inzucchi SE, Køber L, Kosiborod MN, Martinez FA, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2019 Nov 21;381(21):1995–2008.
2. Solomon SD, McMurray JJV, Claggett B, de Boer RA, DeMets D, Hernandez AF, et al. Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction. N Engl J Med. 2022 Sep 22;387(12):1089–98.
3. Packer M, Anker SD, Butler J, Filippatos G, Pocock SJ, Carson P, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med. 2020 Oct 8;383(15):1413–24.
4. Anker SD, Butler J, Filippatos G, Ferreira JP, Bocchi E, Böhm M, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med. 2021 Oct 14;385(16):1451–61.
5. Qiu M, Ding LL, Zhang M, Zhou HR. Safety of four SGLT2 inhibitors in three chronic diseases: A meta-analysis of large randomized trials of SGLT2 inhibitors. Diab Vasc Dis Res. 2021 Mar;18(2):147916412110110.
VOTRE SERVICE DE PHARMACOLOGIE MEDICALE
Les pharmacologues médicaux sont des spécialistes du médicament, médecins et pharmaciens, qui ont pour missions l’évaluation et le suivi de l’efficacité et de la sécurité des médicaments, les vigilances associées aux médicaments et aux drogues, l’information sur le bon usage du médicament et l’enseignement de la pharmacologie médicale auprès des étudiants en santé et des professionnels de santé. Les services de pharmacologie médicale et toxicologie des CHU de Montpellier et de Toulouse regroupent plusieurs structures médicales : centres régionaux de pharmacovigilance et d’information sur le médicament, centres d’addictovigilance, laboratoires de toxicologie et de suivi thérapeutique pharmacologique, unités de pharmacologie clinique et pharmaco-épidémiologie et unité de prévention du dopage.
CHU Toulouse
Service de Pharmacologie Médicale et Clinique
Pr Agnès Sommet
37 allées Jules-Guesde, 31000 Toulouse, France
Centre Régional de Pharmacovigilance, de PharmacoEpidémiologie et d’Informations sur le Médicament (CRPV)
Centre d’Evaluation et d’Informations sur la Pharmacodépendance et d'AddictoVigilance (CEIP-A)
Antenne Médicale de Prévention du Dopage et des conduites dopantes d’Occitanie (Centre Pierre-Dumas)
Evaluation chez la Femme Enceinte des MEdicaments et de leurs RISques (EFEMERIS)
CHU Montpellier
Service de Pharmacologie Médicale et Toxicologie
Dr Olivier MATHIEU
Hôpital Lapeyronie, 371 Avenue du Doyen Gaston Giraud, 34295 Montpellier, France
Centre Régional de Pharmacovigilance (CRPV)
Déclaration en ligne : https://signalement.social-sante.gouv.fr/
Centre d’Addictovigilance
Laboratoire de Toxicologie et de Suivi Thérapeutique Pharmacologique
Informations importantes et alertes concernant le bon usage et la sécurité des médicaments
ANSM
Cannabis médical : point d’étape sur la dernière année de l’expérimentation et l’arrivée de médicaments à base de cannabis (20/02/2024) : lien
Campagne d’information sur les médicaments et la grossesse : Enceinte, les médicaments, c’est (toujours) pas n’importe comment ! (12/03/2024) : lien
Obésité : quel profil d’utilisation de Wegovy en France pendant son accès précoce ? (19/03/2024) : lien
Progestatifs et risque de méningiomes intracrâniens : le BMJ publie une étude épidémiologique française (28/03/2024) : lien
En cas de rhume, ne pas utiliser de médicaments à base de pseudoéphédrine (actualisation 08/04/2024) : lien
Tramadol : moins de comprimés dans les boîtes pour un meilleur usage (10/04/2024) : lien
Campagne vaccinale contre les infections à HPV : les données recueillies après la première dose confirment le profil de sécurité du vaccin Gardasil 9 (29/04/2024) : lien
L’ANSM inscrit de nouveaux cannabinoïdes sur la liste des stupéfiants (24/05/2024) : lien
Diabète de type 2 et tensions d’approvisionnement en a-GLP1 : perspectives d’évolution de la situation et des recommandations (25/04/2024) : lien
EMA
Absence de lien entre les saignements post-ménopausiques et les vaccins à ARNm contre le Covid-19 de Pfizer (Comirnaty) et Moderna (Spikevax) (08/03/2024) : lien
Les données disponibles à ce jour ne permettent pas d’établir un lien de causalité entre les médicaments de la classe des analogues du GLP-1 (glucagon-like peptide-1) et des idées ou actes suicidaires (25/04/2024) : lien
Suspension du marché européen des médicaments à base de caproate d'hydroxyprogestérone (17/05/2024) : lien
SFPT
Tramadol : pourquoi est-il important de prescrire pour une durée la plus courte possible et de privilégier la dispensation des conditionnements de petite taille ? (16/05/2024) : lien
Conséquences iatrogènes des pénuries de médicament en France (17/05/2024) : lien
PLACEBO EDUQUE : UNE NOUVELLE PERSPECTIVE SUR L’EFFET PLACEBO
Jean-Luc FAILLIE, Laura PEYRUSSE (étudiante) (Montpellier)

Le phénomène de l'effet placebo démontre la capacité du cerveau à influencer les réponses physiologiques du corps, offrant un soulagement à une gamme variée de symptômes même en l'absence de principe actif. Cependant, son utilisation est entravée par des considérations éthiques, notamment la nécessité de tromper le patient. En effet, dans les essais cliniques en aveugle, les patients des groupes placebo ne doivent pas savoir quel traitement ils reçoivent. Des recherches menées par une équipe du CNRS à Grenoble ont ouvert de nouvelles perspectives (1).
Les travaux de Ted Kaptchuk en 2010 avaient remis en question l'idée selon laquelle le mensonge était essentiel pour l'effet placebo, tandis que les études ultérieures, notamment celles de Cosima Locher, ont montré que le placebo ouvert, bien que moins efficace que le placebo dissimulé, conserve une certaine efficacité. Nicolas Pinsault à Grenoble a proposé que révéler la nature du placebo et expliquer ses mécanismes neurophysiologiques pourrait compenser cette perte d'efficacité. Une étude menée par l'équipe de recherche grenobloise sur l'analgésie placebo a comparé l'efficacité du placebo éduqué (groupe dans lequel les patients recevaient un placebo en ouvert après avoir visionné une vidéo expliquant les mécanismes neurophysiologiques de l’effet placebo) à celui du placebo mensonger standard. Les résultats révèlent une différence minime d'intensité de la douleur entre les deux groupes (0,7 mm sur l’échelle analogique de 100 mm). Ces résultats ouvrent la voie à une utilisation plus éthique du placebo, promouvant un modèle de prise de décision médicale partagée où le patient joue un rôle actif dans sa propre santé.
1 L’effet placebo en toute transparence | CNRS Le journal
https://lejournal.cnrs.fr/articles/leffet-placebo-en-toute-transparence
LES ESSAIS CLINIQUES DECENTRALISES, QU’EST-CE QUE C’EST ?
Dr Margaux Lafaurie et Dr Yoann Zelmat, Toulouse
La pandémie de COVID-19 a mis en exergue la nécessité d’intégrer des outils numériques dans la recherche clinique pour pallier aux difficultés associées à la centralisation, notamment pour le recrutement et le suivi des patients. En effet, 70 % des patients sont à plus de 2 heures d'un centre d'investigation clinique et 90% des essais cliniques se font dans seulement 10% des centres investigateurs potentiels (1). Les essais cliniques décentralisés ECD (ndlr : il s’agit d’une modalité opératoire et non d’un design) ont pour vocation de répondre à ces enjeux. Leur définition n’est actuellement pas consensuelle et de nombreuses terminologies coexistent compliquant leur identification dans la littérature (virtual, internet-based, online, remote, digital, patient-centric, …).
Les ECD utilisent des technologies, des procédures et/ou des services afin de limiter/éliminer la nécessité pour les participants de se rendre physiquement au site traditionnel de recherche, remplacé alors par le domicile du patient ou un établissement de santé situé à proximité. Progressivement, de nombreux essais cliniques ont adopté des éléments décentralisés tels que agendas électroniques, appels téléphoniques ou rendez-vous en ligne. Désormais, certains essais cliniques sont même totalement décentralisés : du recrutement sur les réseaux sociaux avec signature électronique du consentement, de la réception au domicile du patient du matériel nécessaire à l’étude jusqu’au recueil du critère de jugement à distance. Ces ECD ont pour objectif de faciliter le recrutement des patients et d’inclure des populations habituellement sous-représentées, telles que les patients éloignés des grandes villes ou les populations âgées, mais aussi de limiter le nombre de perdus de vue. Il s’agit également d’un enjeu majeur pour l’industrie pharmaceutique afin de diminuer les coûts de développement des médicaments (priorité n°1 des évolutions en matière d’essais cliniques du LEEM) (2). Cependant, la pertinence de leur utilisation dans un essai clinique dépend de nombreux facteurs, incluant le type d’essai clinique, la population d’étude, la pathologie traitée, l’état de santé du participant et le type de médicament ou d’intervention évalué. Il est fondamental que ces ECD garantissent à la fois les règles d’éthique (confidentialité, sécurité des données, droit des patients) et de rigueur méthodologique afin de fournir des preuves dans le cadre de l’évaluation des médicaments ou autre intervention. Dans ce sens, l’EMA a émis des recommandations en 2022 sur les ECD (3). En France, la CNIL a annoncé le 8 janvier 2024 la mise en place d’une phase pilote d’essais cliniques décentralisés pour une période de six mois pilotée par la DGS, la DGOS, l’ANSM et la CNIL4 et vient de publier des bonnes pratiques pour le contrôle qualité à distance des ECD (5).
Afin d’illustrer cela, nous vous proposons de faire une lecture critique de l’ECD : Thompson B et al.Vitamin D supplementation and major cardiovascular events: D-Health randomised controlled trial. BMJ. 2023;381:e075230. doi: 10.1136/bmj-2023-075230. Cet ECD conduit en Australie de 2014 à 2020 a inclus plus de 21 000 patients suivis sur 5 ans, avec envoi du médicament expérimental au domicile, recueil des données par questionnaire et pour lequel le critère de jugement (événement cardiovasculaire majeur) a été mesuré grâce à l’appariement à une base de données médico-administratives (sans possibilité de comité d’adjudication pour valider les évènements).
1 McKinsey & Company - No place like home? Stepping up the decentralization of clinical trials. Juin 2021. Disponible à : https://www.mckinsey.com/industries/life-sciences/our-insights/no-place-like-home-stepping-up-the-decentralization-of-clinical-trials.
2 Etude IQVIA pour Les entreprises du médicament LEEM : Essais cliniques 2030 - La révolution de la recherche clinique. Mars 2022. Disponible à : https://www.leem.org/publication/etude-essais-cliniques-2030-la-revolution-de-la-recherche-clinique
3 European Medicine Agency (EMA) - Recommendation paper on decentralised elements in clinical trials - Décembre 2022. Disponible à : https://health.ec.europa.eu/latest-updates/recommendation-paper-decentralised-elements-clinical-trials-2022-12-14_en.
4 Commission Nationale Informatique et Libertés (CNIL) : Essais cliniques décentralisés : lancement d’une phase pilote par la DGS, la DGOS, l’ANSM et la CNIL. Janvier 2024. Disponible à : https://www.cnil.fr/fr/essais-cliniques-decentralises-lancement-dune-phase-pilote-par-la-dgs-la-dgos-lansm-et-la-cnil
5 Commission Nationale Informatique et Libertés (CNIL) : Essais cliniques : les bonnes pratiques pour le contrôle qualité à distance. Mai 2024. Disponible à : https://cnil.fr/fr/essais-cliniques-les-bonnes-pratiques-pour-le-controle-qualite-distance
ALTÉRATION DE LA COULEUR DENTAIRE INDUITE PAR LES MÉDICAMENTS
Mathilde Rey (étudiante), Christelle Philibert (Montpellier)
Certains médicaments peuvent provoquer une modification de la coloration des dents ayant pour conséquence non seulement un problème clinique, mais également esthétique.
Une analyse publiée en 2023 a utilisé les données de déclaration des événements indésirables de la Food and Drug Administration US entre 2004 et 2021 : les analyses de disproportionnalité ont mis en évidence des signaux de dyschromie dentaire pour 25 médicaments (1). Parmi eux, on retrouve, la tétracycline, des corticoïdes inhalés tels que la fluticasone, budesonide puis l’amoxicilline et les antiseptiques utilisés en bains de bouche tels que la chlorexidine et le chlorure de céthylpéridinium.
Les biphosphonates sont également susceptibles de modifier la coloration des dents principalement en raison de leur interaction avec les cristaux d’hydroxyapatite (principal composant minéral des os et des dents chez les vertébrés) mais aussi potentiellement par leur action sur l’œsophage et/ou la muqueuse gastrique en provoquant des reflux gastro-oesophagiens.
Les tétracyclines ont été pointées du doigt pour leurs atteintes des tissus dentaires (émail et dentine via l’hydroxyapatite) lors des périodes de calcification in utero (14ème semaine) et à partir du troisième mois de vie et sont contre-indiquées chez la femme enceinte, allaitante et l’enfant de moins de 8 ans.
Plus la coloration des tissus minéralisés est profonde (dentine) plus le traitement correcteur sera long et invasif. A l’inverse, l’altération de la couleur dentaire liée à l’amoxicilline ou aux corticoïdes inhalés (budésonide et la fluticasone) est réversible après un brossage des dents efficace ou un nettoyage chez un dentiste.
Certaines classes médicamenteuses sont bien identifiées comme responsables de dyschromie dentaire indiquées dans le RCP mais ce n’est pas clairement mentionné pour toutes.
UN RISQUE D’INTERACTION MECONNU AVEC LE TOCILIZUMAB (ROACTEMRA®)
Candice CESBRON, Claire DE CANECAUDE, Toulouse
Le tocilizumab (Roactemra®) a fait récemment l’objet d’une question concernant une possible interaction avec le rivaroxaban (Xarelto®). Le patient âgé de 74 ans était traité par rivaroxaban pour une fibrillation atriale, le tocilizumab avait été récemment introduit pour une polyarthrite rhumatoïde cortico-résistante et la question portait sur une augmentation du risque d’événements thrombotiques par diminution de l’efficacité du rivaroxaban.
D’un point de vue pharmacologique, le rivaroxaban est un anticoagulant oral direct métabolisé modérément par le cytochrome CYP 3A4. Le tocilizumab est un anticorps anti-interleukine 6 (IL-6) qui se lie à ses récepteurs membranaires et solubles et bloque ainsi la transmission du signal pro-inflammatoire. Or, le tocilizumab n’est ni inhibiteur, ni inducteur des cytochromes, et pourtant des interactions liées à ces derniers sont décrites et retrouvées dans sa monographie et la littérature (revue de la littérature [1]). Mais par quel mécanisme ?
Physiologiquement l’IL-6 génère un signal participant à différents processus notamment :
- L’activation des lymphocytes T,
- L’induction de la sécrétion d’immunoglobulines,
- La stimulation de l’hématopoïèse
- L’induction de la synthèse des protéines hépatiques de l’inflammation aiguë et en conséquence supprime l’expression des iso-enzymes hépatiques du CYP450 notamment des CYP1A2, 2C9, 2C19 et 3A4
Par conséquent, l’expression des iso-enzymes du CYP450 peut être restaurée lors de la mise en place d’un traitement par tocilizumab et ainsi déséquilibrer la prise au long cours d’un médicament métabolisé par ces cytochromes.
Ainsi, lors d’une instauration de tocilizumab, ce risque d’interaction pharmacocinétique est à prendre en considération pour une éventuelle adaptation posologique des médicaments substrats du CYP1A2, 2C9, 2C19 et/ou 3A4 pour lesquels la concentration plasmatique pourrait être modifiée (pour les médicaments avec des métabolites actifs : augmentation de la concentration de ces métabolites ; métabolites inactifs : diminution de la concentration du médicament).
Ci-dessous quelques médicaments substrats majeurs de ces cytochromes :
LE RISQUE D'AGRANULOCYTOSE INDUITE PAR LA CLOZAPINE DIMINUE FORTEMENT AVEC LE TEMPS, MAIS RESTE SUPERIEUR A CELUI DES AUTRES ANTIPSYCHOTIQUES
Lola Franco (étudiante), Virginie Bres et Jean-Luc Faillie (Montpellier)
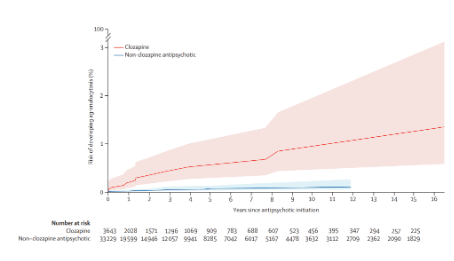
Bien qu'elle soit le seul médicament autorisé pour traiter la schizophrénie résistante, la clozapine est sous-utilisée en raison des craintes que suscite le risque d'agranulocytose et la surveillance sanguine contraignante associée. Pourtant, le profil à long terme de cette complication potentiellement mortelle n'a pas encore été bien établi. Une étude récente a été conduite sur la totalité des patients finlandais sans antécédent d'agranulocytose ayant reçu un diagnostic de schizophrénie ou de trouble schizo-affectif entre 1972 et 2014 (n=61 769 ; 46,7 ans en moyenne, 50.3% d’hommes). Les auteurs ont d'abord réalisé une courbe de Kaplan-Meier pour étudier le risque cumulé d'agranulocytose en fonction du type d'antipsychotique sur une période d'observation de 22 ans (de 1996 à 2017). Ils ont ensuite réalisé une étude cas-témoins nichée pour étudier l’association entre la durée de traitement par la clozapine (et par les autres antipsychotiques) et l'agranulocytose.
Les auteurs ont ainsi déterminé une incidence absolue cumulée d’agranulocytose de 1,37% (95% CI 0,58-3,16) sous traitement par clozapine et de 0,13% (0,04-0,23) sous autres antipsychotiques pendant les 22 années d'observation. Dans le modèle cas (n=398) versus témoins (n=1987), le risque d'agranulocytose associé à la clozapine diminue fortement avec le temps, passant d'un odd-ratio ajusté (aOR) de 36,01 (95% CI 16,79-77,22) pour moins de 6 mois de traitement à 4,38 (1,86-10,34) pour plus de 54 mois. Chez les patients traités par d’autres antipsychotiques, le risque d’agranulocytose est également plus important au cours des 6 premiers mois de traitement, mais avec un aOR de seulement 4,23 (2·02–8·88), qui n’est ensuite plus significatif.
L’étude indique que le risque d'agranulocytose induite par la clozapine diminue fortement avec le temps, tout en restant néanmoins supérieur à celui des autres antipsychotiques. Les auteurs notent que ce risque à long terme semble modéré par rapport aux bénéfices bien établis de la clozapine et ils s'interrogent sur un éventuel assouplissement de la surveillance hématologique après les premières années de traitement.
Bien que cette étude offre des résultats encourageants quant à l’utilisation prolongée de la clozapine, elle présente des limites, notamment en ce qui concerne l'uniformité du seuil clinique diagnostique de l'agranulocytose, en raison de l’absence de données sur les chiffres absolus de neutrophiles. D’autres recherches sont nécessaires pour confirmer la généralisation de ces résultats, notamment en tenant compte des modalités nationales de surveillance thérapeutique mais également des variations ethniques dans le risque d’agranulocytose.
AGONISTES DU GLP-1, RALENTISSEMENT DE LA VIDANGE GASTRIQUE ET RISQUE D’ASPIRATION EN CAS D’ANESTHESIE.
Romain Barus, Claire de Canecaude, Toulouse
Les agonistes du GLP-1 en ralentissant la vidange gastrique pourraient exposer à un risque d’aspiration sous anesthésie ; c’est-à-dire au passage du contenu gastrique dans les voies respiratoires exposant à un risque d’obstruction des voies respiratoires ou de pneumopathie par inhalation, avant ou après l'extubation, quand le patient a encore un niveau de conscience altéré (1).
Dans une étude transversale récente, la prise d’agoniste du GLP-1 augmentait de plus de 2 fois le risque de présenter un contenu gastrique résiduel (présence de solide, liquides épais ou plus de 1,5mL/Kg de liquides clairs à l’échographie gastrique) en pré-opératoire en comparaison aux patients n’en prenant pas (2).
La présence d’un contenu gastrique résiduel chez les patients ayant des agonistes du GLP-1 implique-t-elle un risque d’aspiration majoré ? Deux études de cohorte rétrospectives menées sur des bases de données médico-administratives ont trouvé des résultats contradictoires à ce sujet (3,4). L’étude de Barlowe et al., menée chez des habitants de Caroline du nord aux Etats-Unis ne retrouvait pas d’augmentation du risque d’aspiration avec les agonistes du GLP-1 en comparaison aux inhibiteurs de la dipeptidyl peptidase 4 (OR=0,67 [0,25-1,75]) et aux médicaments opioïdes (OR=0,60 [0,24-1,52]) (3). En revanche, une étude de plus grande ampleur menée sur des données mondiales et utilisant un score de propension suggérait que le risque d’aspiration était augmenté (HR=1,33 [1,02-1,74]) chez les utilisateurs d’agonistes du GLP-1 comparé aux non-utilisateurs (4).
En pratique, l’arrêt des agonistes du GLP-1 est recommandé en pré-opératoire tant dans le diabète que dans l’obésité, en prenant en compte la longue demi-vie de ces médicaments et en concertation avec le prescripteur.
(1) Anesthésie et médicaments agonistes du GLP-1 utilisés dans le diabète et la perte de poids : risque d’inhalation bronchique du contenu gastrique n.d. https://www.prescrire.org/fr/3/31/67824/0/NewsDetails.aspx (accessed May 21, 2024).
(2) Sen S, Potnuru PP, Hernandez N, Goehl C, Praestholm C, Sridhar S, et al. Glucagon-Like Peptide-1 Receptor Agonist Use and Residual Gastric Content Before Anesthesia. JAMA Surgery 2024. https://pubmed.ncbi.nlm.nih.gov/38446466/
(3) Barlowe TS, Anderson C, Sandler RS, Subramaniam D, Muratore A, Buse JB, et al. Glucagon-like peptide-1 receptor agonists do not increase aspiration during upper endoscopy in patients with diabetes. Clinical Gastroenterology and Hepatology 2024;0. https://www.cghjournal.org/article/S1542-3565(24)00453-1/abstract
(4) Yeo YH, Gaddam S, Ng WH, Huang P-C, Motility and Metabolic Pharmacoepidemiology Group, Sheng-Kai Ma K, et al. Increased Risk of Aspiration Pneumonia Associated With Endoscopic Procedures Among Patients With Glucagon-like Peptide 1 Receptor Agonist Use. Gastroenterology 2024:S0016-5085(24)00298-1. https://www.gastrojournal.org/article/S0016-5085(24)00298-1/abstract
CONTRACEPTION D’URGENCE HORMONALE, QUELLES INTERACTIONS ?
Clémence Jutard et Alexia Tardy (internes en pharmacie), Cosette Le Souder, Marie-Andrée Thompson-Bos (Montpellier)
La demande d’une contraception d’urgence hormonale souvent appelée « pilule du lendemain », est une situation relativement fréquente à l’officine. C’est une méthode de rattrapage qu’une femme peut utiliser pour prévenir la survenue d’une grossesse non prévue après un rapport non ou mal protégé.
Parmi les spécialités disponibles on distingue celles à base de lévonorgestrel, un progestatif utilisé en dose unique de 1.5 mg per os et utilisable dans les 3 jours suivant le rapport sexuel et celles à base d’ulipristal acétate, un modulateur synthétique sélectif des récepteurs de la progestérone utilisé en dose unique de 30 mg per os et utilisable dans les 5 jours suivant le rapport sexuel.
Comme pour tout médicament, des interactions médicamenteuses sont possibles. Différents mécanismes peuvent conduire à une diminution de l’efficacité médicamenteuse de la contraception d’urgence :
- La prise concomitante d’un médicament inducteur enzymatique (quelques exemples d’inducteurs puissants : phénobarbital, phénytoïne, primidone, carbamazépine, rifabutine, rifampicine, griséofulvine, certains antirétroviraux, ivacaftor/ivacaftor (Orkambi®), encorafenib (Braftovi®), millepertuis). Attention, pour les femmes qui ont utilisé des médicaments inducteurs enzymatiques dans les 4 dernières semaines et qui ont besoin d'une contraception d'urgence, l’effet inducteur enzymatique de ces médicaments peut persister jusqu’à 1 mois après l’arrêt du traitement. Pour ces femmes, une alternative peut être d’informer sur la possibilité d’avoir recours à une contraception d’urgence non hormonale : DIU au cuivre (jusqu’à 5 jours après le rapport sexuel).
- La diminution de l’absorption orale du contraceptif pris par voie orale : cela concerne tous les médicaments susceptibles de provoquer des vomissements et des diarrhées aqueuses sévères. De manière non exhaustive, on retrouve les laxatifs, l’orlistat, les chimiothérapies pourvoyeuses de nausées, la colchicine, la morphine. La survenue de vomissements dans les trois heures après un contraceptif oral fait considérer ce dernier comme inefficace et nécessite de reprendre un comprimé.
- L’utilisation de l’ulipristal acétate n’est pas recommandée chez les patientes utilisant une contraception hormonale, car il existe alors une compétition au niveau des récepteurs à la progestérone pouvant conduire à une diminution d’efficacité (voir BIP 2023 n°1).
En conclusion, lors d’une demande de « pilule du lendemain », il est important de connaître les médicaments pris par la patiente dans le mois précédent, afin de ne pas exposer la femme à un risque d’inefficacité de la contraception hormonale d’urgence. Si elle est moins connue, la méthode non hormonale (DIU au cuivre dans les 5 jours suivant le rapport) peut être une option dans certaines situations.
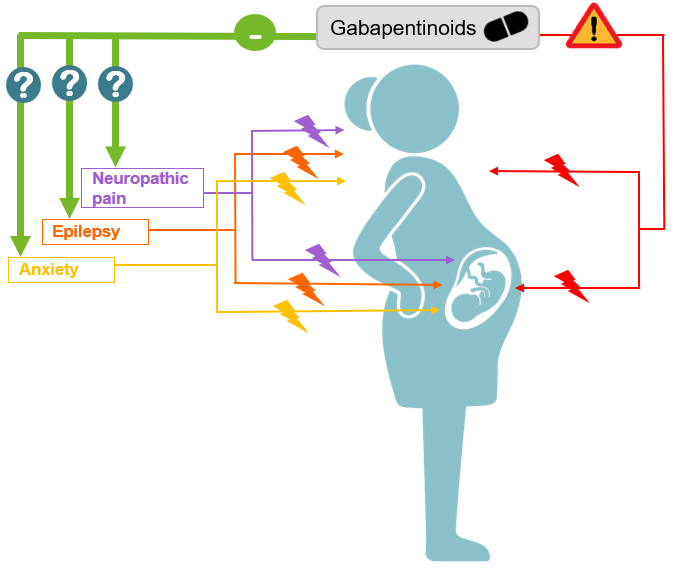
GABAPENTINOÏDES PENDANT LA GROSSESSE : DES PRESCRIPTIONS EN AUGMENTATION EN EUROPE. OUI, MAIS DANS QUELLE(S) INDICATION(S) ?
Anna-Belle Beau (Toulouse)
Les gabapentinoïdes (gabapentine et prégabaline), commercialisés en Europe pour le traitement de l’épilepsie, des douleurs neuropathiques et du trouble anxieux généralisé (prégabaline seulement), sont en augmentation d'utilisation pendant la grossesse et suscitent des préoccupations croissantes quant à leurs effets sur la grossesse et l’enfant à naître. L’évaluation de la sécurité de leur utilisation pendant la grossesse par le biais d’études de pharmaco-épidémiologie n’est pas simple, car elle nécessite de pouvoir distinguer les effets des médicaments de ceux de la pathologie maternelle, or la plupart des bases de données médico-administratives n’enregistrent pas les raisons spécifiques pour lesquelles les médicaments ont été prescrits.
A Toulouse, nous avons développé un algorithme pour détecter les indications potentielles des gabapentinoïdes utilisés pendant la grossesse (1). Cette étude européenne, conduite au sein de six sources de données, entre 2006 et 2020, portait sur 3,2 millions de grossesses. En utilisant une approche exhaustive de l’ensemble des données disponibles telles que les co-prescriptions, la spécialité du prescripteur, les diagnostics hospitaliers, de médecins généralistes, ou de spécialistes, nous avons pu identifier les raisons potentielles de la prescription des gabapentinoïdes dans une proportion significative de grossesses exposées, variant de 43% à 90% selon les sources de données. L'épilepsie était l'indication la moins documentée (en dessous de 15 %). En revanche, l'anxiété était l'indication la plus documentée en Finlande, Italie, Espagne et Pays de Galles, tandis que la douleur neuropathique prédominait dans les données françaises et norvégiennes. Nos résultats démontrent la pertinence d’utiliser l’ensemble des données disponibles pour identifier les indications potentielles de prescription, permettant la conduite d’études sur l’utilisation et de sécurité des médicaments pendant la grossesse en fonction de la pathologie maternelle même quand celle-ci n’est pas directement renseignée.
ECOPHARMACOLOGIE : IMPACTS ENVIRONNEMENTAUX DE LA POLYMEDICATION ANTICHOLINERGIQUE
Jean-Luc FAILLIE (Montpellier)
Un article récent du BMJ s’est intéressé à l'impact négatif des médicaments anticholinergiques sur le plan clinique mais aussi, de manière surprenante, sur l’environnement (1).
De nombreux médicaments couramment prescrits présentent une action anticholinergique : antidépresseurs tricycliques, antipsychotiques (en particulier phénothiazines, clozapine, loxapine), antihistaminiques, antiparkinsoniens, bronchodilatateurs, médicaments de l’incontinence urinaire mais aussi, dans une moindre mesure, diurétique de l’anse, opioïdes, inhibiteurs calciques, ISRS etc. La polymédication, fréquente dans la population âgée, peut exposer les patients à une charge anticholinergique élevée qui augmente le risque iatrogène : confusion, chutes, fractures, déclin cognitif, sécheresse buccale et cutanée, tachycardie, constipation, troubles visuels... Mais elle s’accompagne aussi d’effets environnementaux.
La prescription de médicaments représenterait 20% de l'empreinte carbone du système de santé britannique (NHS), principalement en raison des coûts associés à la fabrication, l'emballage, la distribution et l'élimination des médicaments. Chaque étape de ce processus consomme de l'énergie et des ressources, contribuant ainsi aux émissions de gaz à effet de serre. Les consultations, hospitalisations, transports ainsi que les examens complémentaires biologiques ou d’imagerie pour évaluer et gérer les effets indésirables anticholinergiques ont une empreinte carbone notable. A titre d’exemple, une journée d'hospitalisation est estimée correspondre à une empreinte carbone de 125 kg de CO2e (équivalent CO2), une consultation en soins aigus à 77 kg de CO2e, et une visite chez le généraliste à 66 kg de CO2e.
Ainsi, déprescrire les médicaments anticholinergiques présente un double avantage : améliorer la sécurité des patients et réduire significativement l'empreinte carbone du système de santé. L'adoption d'alternatives non médicamenteuses (ex. approches psychothérapeutiques pour traiter l'insomnie ou l'anxiété) pourrait également y contribuer. Cependant, leur empreinte carbone n'a pas encore été quantifiée de manière précise.
1. Smith H, Fligelstone H. Reducing patient and planetary harms from high anticholinergic burden medication. BMJ. 2024 Jan 15;384:e075708. doi: 10.1136/bmj-2023-075708.
LA SATIETE DE CONSOMMATION N’EXISTE PAS !
Claire de Canecaude, François Montastruc, Romain Barus (Toulouse)

BIP Occitanie a déjà parlé de la folie des agonistes du GLP-1. Nous vous racontons la suite de cette saga qui est un exemple de pharmacologie sociale.
Pour rappel, ces médicaments miment l’hormone intestinale (incrétine) sécrétée par l’intestin lors des repas et stimulant la sécrétion d’insuline en réponse à une hyperglycémie. Cette hormone agit également au niveau central en ralentissant la vidange gastrique et entraine un effet satiétogène qui réduit la prise alimentaire. Ces médicaments initialement indiqués dans le diabète possèdent désormais pour le sémaglutide ou le liragultide une AMM chez les patients obèses non diabétiques aux Etats-Unis et plus récemment en Europe. Depuis novembre 2023, le tirzépatide (analogue du GLP-1 et du GIP) vient d’arriver sur le marché aux USA dans la même indication.
Les nombreuses vidéos circulant sur les réseaux sociaux font naitre un espoir (et une folie !) immense notamment aux Etats-Unis où l’obésité et le surpoids touchent près de 70% des adultes. Dès octobre 2022, Elon Musk faisait la promotion du sémaglutide sur Twitter. En octobre 2023, la presse grand public [1] annonçait que les succès du sémaglutide avaient conduits à une intervention du patron de Walmart indiquant un infléchissement des achats de nourriture et un report vers l’achat de produits moins caloriques chez ses clients … à l’origine de la chute en bourse des principales marques de snacking et de boissons gazeuses. Au même moment, la valorisation boursière du laboratoire NovoNordisk a dépassé le PIB du Danemark …
L’adaptation des géants de l’agroalimentaires ne s’est pas faite attendre longtemps et Nestlé vient d’annoncer aux Etats-Unis le lancement d’une gamme de produits spécialement destinés aux utilisateurs des agonistes du GLP-1 « Vital Pursuit » [2] ! Cette gamme de produits (Pizza, pates…en petite portion !) sera riche en protéines, en fibres et en nutriments essentiels. L’entreprise suggère que ces produits serviront à combler les éventuelles carences liées à l’utilisation de ces médicaments « coupe-faim ».
On connaissait dans l’agroalimentaire les alicaments (ces produits alimentaires présentés comme des médicaments), il existe désormais des produits pour accompagner la prescription médicamenteuse. Le succès des agonistes du GLP-1 créé donc un nouveau marché qui n’a jamais de sentiment de satiété.
[2] Nestlé introduces Vital Pursuit brand to support GLP-1 users in the US– Nestlé Global 2024.
DISPOSITIFS TRANSDERMIQUES A BASE DE FENTANYL : DONNEES D’ADDICTOVIGILANCE
Charlène Ain, Céline Eiden, Hélène Peyrière, Centre d’Addictovigilance, Montpellier
La mise à jour des données d’addictovigilance sur les dispositifs transdermiques à base de fentanyl a été réalisée sur la période de 2020 à 2022. Sur la période, 57 notifications spontanées (NotS) ont été retenues et analysées, chez majoritairement des hommes (74%, n=42), avec un âge moyen de 44,5 ± 14 ans [écart : 15-84 ans].
Des pratiques de mésusage avec des détournements de la voie d’administration (n=24) sont observées. Les patchs de fentanyl peuvent être mésusés par voie orale (les patchs sont mâchés n=5, placés en sublingual n=4, sucés n=3, collés aux gencives n=2), par voie injectable (n=6) ou fumée (n=2). Un mésusage par modification des modalités d’utilisation est retrouvé dans 45,6% des cas (n=26). Les patchs de fentanyl sont pris de manière trop rapprochée (<48h) ou encore en grande quantité (n=28, 64% > 62.5 µg/h) ce qui expose les individus à un surdosage en fentanyl.
Concernant les effets recherchés, renseignés dans 35% des cas (n=20), deux profils de consommation semblent persister avec le temps : (1) un profil de recherche d’effet antalgique dans 55% (n=11) des cas, chez majoritairement des femmes (54,5%), d’âge moyen 53,8 ans, présentant dans 63,3% (n=7) des antécédents addictifs et/ou psychiatriques dans le but de traiter des douleurs chroniques d’origine non cancéreuse et (2) un profil de recherche d’effet récréatif (effets psychiques positifs) dans 45% (n=9) des cas. Il est constaté plutôt chez les hommes (77%), d’âge moyen 48 ans, présentant dans 87,5% (n=7) des antécédents addictifs et/ou psychiatriques. Le nombre de sujets correspondant à ce profil est en augmentation Par rapport aux précédentes évaluations (28% versus 10%). Dans 54% (n=31) des NotS, des co-médications sont retrouvées comme des antalgiques dans 61% (n=19), des traitements de substitution aux opioïdes dans 29% (n=9) et des benzodiazépines dans 22,5% (n=7) des cas. La prise simultanée de substances illicites est évoquée dans 26% des cas (n=8).
L’analyse des données des outils d’addictovigilance (OPPIDUM, ASOS, OSIAP) montre une stabilité par rapport au précédent bilan. Concernant le dispositif DRAMES en lien avec la surveillance des décès, on constate plusieurs cas de décès (n=5) entre 2019 et 2021 dans un contexte d’abus et/ou dépendance (moins de 2/an en comparaison avec le précédent bilan à en moyenne 5/an).
En raison de la toxicité du fentanyl et du risque de décès dans le cadre d’usage thérapeutique ou d’un usage à des fins non médicales, tous les professionnels de santé doivent rester vigilants pour la prescription, la délivrance et l’administration afin de participer activement au bon usage de la prescription de cette forme galénique.
L’INSOUTENABLE ABSENCE DU SUIVI THERAPEUTIQUE PHARMACOLOGIQUE DANS LES ESSAIS DE PHASE III DES NOUVEAUX CANDIDATS MEDICAMENTS
Florian Lemaître, Rennes
Récemment, Limaye et collègues ont démontré la non-infériorité du letermovir, un inhibiteur de terminase du cytomégalovirus (CMV), par rapport au valganciclovir, le traitement prophylactique de de l’infection à CMV chez les transplantés rénaux séronégatifs pour le CMV recevant un organe séropositif pour le CMV (1). Dans cet essai, la survenue d’une maladie à CMV à S52 n'était pas différente entre les groupes letermovir (10,4%) et valganciclovir (11,8%). De plus, l'analyse de sécurité montrait plus de leucopénies, de neutropénies et finalement plus d'arrêts de traitement dus à des effets indésirables liés au médicament dans le bras valganciclovir. Ces résultats peuvent sembler à première vue très positifs pour le letermovir. Cependant, le bras valganciclovir a sans doute été désavantagé par le design de l'essai. En effet, efficacité et sécurité du ganciclovir, la forme active du valganciclovir, sont liées à son exposition et la très grande variabilité pharmacocinétique interindividuelle du médicament est connue (2,3). Ainsi, une grande partie des patients pourrait avoir été sous-exposée au ganciclovir dans cette étude, ce qui désavantagerait le groupe contrôle. Ne pas inclure le suivi thérapeutique pharmacologique (STP) du ganciclovir dans un essai comparatif empêche d'évaluer correctement l'effet de ce médicament. Une telle faiblesse dans la conception des essais a déjà été constatée dans l'essai SECURE visant à comparer l'isavuconazole et le voriconazole pour le traitement des infections fongiques invasives, où ce dernier médicament n'a pas bénéficié d'une stratégie axée sur le STP malgré des années de démonstration de la grande variabilité et du lien établi entre exposition et réponse du voriconazole (4).
Enfin, on peut également s'interroger sur la raison d'être d'un essai de non-infériorité dans le cas d'un médicament très onéreux. Compte tenu de l'impact médico-économique potentiel du letermovir (plus de 18000 € pour un traitement de 2 mois), la démonstration d’une supériorité devrait sans doute être recherchée. Les agences de régulation devraient probablement établir : des règles strictes concernant l'intervention appropriée pour éviter de biaiser négativement les résultats du bras contrôle, notamment le recours au STP systématique pour les médicaments dont la pharmacocinétique est très variable, et des approches médico-économiques pour évaluer le rapport coût-efficacité des médicaments expérimentaux coûteux en cours d'évaluation.
References:
1. Limaye AP, Budde K, Humar A, et al. Letermovir vs Valganciclovir for Prophylaxis of Cytomegalovirus in High-Risk Kidney Transplant Recipients: A Randomized Clinical Trial. JAMA. 2023;330(1):33-42. doi:10.1001/jama.2023.9106
2. Wiltshire H, Paya CV, Pescovitz MD, et al. Pharmacodynamics of oral ganciclovir and valganciclovir in solid organ transplant recipients. Transplantation. 2005;79(11):1477-1483. doi:10.1097/01.tp.0000164512.99703.ad
3. Märtson AG, Edwina AE, Burgerhof JGM, et al. Ganciclovir therapeutic drug monitoring in transplant recipients. J Antimicrob Chemother. 2021;76(9):2356-2363. doi:10.1093/jac/dkab195
4. Maertens JA, Raad II, Marr KA, et al. Isavuconazole versus voriconazole for primary treatment of invasive mould disease caused by Aspergillus and other filamentous fungi (SECURE): a phase 3, randomised-controlled, non-inferiority trial. Lancet. 2016;387(10020):760-769. doi:10.1016/S0140-6736(15)01159-9

BIP Occitanie fait partie de l'International Society of Drug Bulletins (ISDB)