BIP 2025 N°3

Editorial
Le ministère de la Santé a récemment confié une mission sur la désinformation en santé à trois experts indépendants, dont le Pr Mathieu Molimard, vice-président de la Société Française de Pharmacologie et Thérapeutique. Cette nomination témoigne d’une prise de conscience de l’importance stratégique du sujet, mais le défi reste considérable
Le cas du Beyfortus (nirsévimab) est emblématique. À la veille du lancement de la campagne nationale contre le VRS, une vidéo conspirationniste relayée par des médias complaisants a tenté de discréditer cet anticorps monoclonal pourtant validé par des données cliniques solides et une pharmacovigilance en vie réelle sur plus de six millions d’enfants. La SFPT a réagi rapidement en publiant un argumentaire sur son site, mais le mal était fait. Il est bien plus difficile de rétablir la vérité que de propager une fake news, surtout lorsqu’il s’agit de traitements préventifs chez les enfants.
Il faut parfois aussi savoir convaincre au sein même de la communauté médicale. La demande d’accès précoce du Leqembi (lécanémab), nouvel anticorps monoclonal ciblant les dépôts amyloïdes, a été justement refusé par la HAS sur la base de son efficacité trop modeste, d’un profil de sécurité préoccupant et des réalités médico-économiques. Cette décision est contestée par les associations de patients et certains neurologues. Le débat est d’autant plus difficile que la maladie d’Alzheimer suscite une attente immense de la part des patients et des soignants, où toute innovation thérapeutique tend à être perçue comme un réel progrès.
Le plus grand risque est que la désinformation contamine nos propres institutions, comme on le voit aujourd’hui aux États-Unis, où les dérives sont effrayantes et les conséquences désastreuses. Sous l’influence de responsables politiques anti-science, le département américain de la Santé publie des rapports alarmants suggérant un lien entre le paracétamol et l’autisme. En Floride, toutes les obligations vaccinales ont été levées, y compris pour les enfants scolarisés, et les CDC, autrefois référence mondiale, sont discrédités par des purges politiques.
La lutte contre la désinformation médicale mérite donc un engagement soutenu et des actions coordonnées. Les fake news en santé ne relèvent pas de la liberté d’opinion : elles constituent un risque réel pour la santé publique.
Pr Jean-Luc Faillie
CHU Montpellier
Service de Pharmacologie Médicale et Toxicologie
Dr Olivier MATHIEU
Hôpital Lapeyronie, 371 Avenue du Doyen Gaston Giraud, 34295 Montpellier, France
Centre Régional de Pharmacovigilance (CRPV)
Déclaration en ligne : https://signalement.social-sante.gouv.fr/
Centre d’Addictovigilance
Laboratoire de Toxicologie et de Suivi Thérapeutique Pharmacologique
CHU Toulouse
Service de Pharmacologie Médicale et Clinique
Pr Agnès Sommet
37 allées Jules-Guesde, 31000 Toulouse, France
Centre Régional de Pharmacovigilance, de PharmacoEpidémiologie et d’Informations sur le Médicament (CRPV)
Centre d’Evaluation et d’Informations sur la Pharmacodépendance et d'AddictoVigilance (CEIP-A)
Antenne Médicale de Prévention du Dopage et des conduites dopantes d’Occitanie (Centre Pierre-Dumas)
Evaluation chez la Femme Enceinte des MEdicaments et de leurs RISques (EFEMERIS)
VOTRE SERVICE DE PHARMACOLOGIE MEDICALE
Les pharmacologues médicaux sont des spécialistes du médicament, médecins et pharmaciens, qui ont pour missions l’évaluation et le suivi de l’efficacité et de la sécurité des médicaments, les vigilances associées aux médicaments et aux drogues, l’information sur le bon usage du médicament et l’enseignement de la pharmacologie médicale auprès des étudiants en santé et des professionnels de santé. Les services de pharmacologie médicale et toxicologie des CHU de Montpellier et de Toulouse regroupent plusieurs structures médicales : centres régionaux de pharmacovigilance et d’information sur le médicament, centres d’addictovigilance, laboratoires de toxicologie et de suivi thérapeutique pharmacologique, unités de pharmacologie clinique et pharmaco-épidémiologie et unité de prévention du dopage.
Sommaire
- INFORMATIONS IMPORTANTES - ALERTES
- PHARMACOLOGIE CLINIQUE
- PHARMACOVIGILANCE
- PHARMACO-EPIDEMIOLOGIE
- MEDICAMENTS, REPRODUCTION ET PERINATALITE
- PHARMACOLOGIE SOCIALE
- ADDICTOVIGILANCE
- PHARMACOLOGIE - TOXICOLOGIE
Informations importantes et alertes concernant le bon usage et la sécurité des médicaments
ANSM
Progestatifs : les mesures sanitaires de réduction du risque montrent leur efficacité avec une diminution massive de l’utilisation des acétates de nomégestrol et de chlormadinone et des méningiomes intracrâniens (13/06/2025) : lien
Augmentation des intoxications causées par des produits à base de CBD contenant d’autres substances (19/06/2025) : lien
Les analogues du GLP-1 indiqués dans le traitement de l’obésité peuvent être prescrits par tout médecin (20/06/2025) : lien
Médicaments de l’insomnie : des boîtes de zopiclone, zolpidem et nitrazépam avec moins de comprimés pour un meilleur usage (30/06/2025) : lien
Arrêt de commercialisation de Vitamine A Dulcis (pommade ophtalmique) : recommandations et alternatives (01/07/2025) : lien
Chikungunya : premiers résultats de l’enquête sur les effets indésirables du vaccin Ixchiq (02/07/2025) : lien
Recommandations dans l’utilisation d’alternatives à certains médicaments dérivés du sang du LFB (03/07/2025) : lien
Migration de l’implant contraceptif Nexplanon dans l’artère pulmonaire : bilan et nouvelles recommandations (04/07/2025) : lien
Ajout de nouvelles benzodiazépines de synthèse (designer benzodiazepines) sur la liste des substances psychotropes (10/07/2025) : lien
Produits de contraste iodés : rappel de la conduite à tenir face aux réactions cutanées d’hypersensibilité retardée (16/07/2025) : lien
Arrêt de commercialisation de Cynomel : Thybon 20 Henning prendra le relais (17/07/2025) : lien
Antiépileptiques pendant la grossesse entre 2013 et 2021 : une étude du GIS EPI-PHARE met en évidence une baisse importante de l’exposition au valproate et dérivés, mais moindre pour le topiramate et la carbamazépine (24/07/2025) : lien
Dérivés de la kétamine : l’ANSM classe de nouvelles substances sur la liste des stupéfiants (05/08/2025) : lien
- Ce sujet fait l’objet d’un article dans la rubrique addictovigilance de ce numéro
Campagne de vaccination contre les infections à papillomavirus humains (HPV) : le vaccin Gardasil 9 confirmé comme sûr (21/08/2025) : lien
Quétiapine 300 mg et 400 mg LP : conduites à tenir dans un contexte de fortes tensions d’approvisionnement (27/08/2025) : lien
Alerte sur les risques associés à l’achat sur internet d’aGLP-1 contrefaits (09/09/2025) : lien
EMA
Ixchiq : levée de la contre-indication temporaire pour la vaccination chez les personnes âgées de 65 ans et plus (11/07/2025) : lien
Conclusion de la revue du risque d'encéphalite avec les vaccins contre la varicelle (11/07/2025) : lien
Le PRAC évalue de nouvelles données sur le risque potentiel de troubles neurodéveloppementaux chez les enfants nés de pères traités avec du valproate (11/07/2025) : lien
Clozapine : Révision des recommandations pour la surveillance systématique de la numération sanguine (11/07/2025) : lien
- Ce sujet fait l’objet d’un article dans la rubrique pharmacovigilance de ce numéro
Première reformulation d'un médicament inhalé avec un gaz propulseur respectueux de l'environnement (anglais) (25/07/2025) : lien
SFPT
Association de méningiomes intracrâniens relevant de la chirurgie et l’utilisation prolongée de désogestrel (19/06/2025) : lien
Traitement de la narcolepsie de type 1 par un agoniste des récepteurs de l'orexine (oveporexton) (30/06/2025) : lien
Traitement du carcinome bronchique à petites cellules par le tarlatamab (25/08/2025) : lien
Nirsévimab (Beyfortus) et prévention de la bronchiolite du nourrisson (02/09/2025) : lien
Zilebesiran : un ARN antihypertenseur
Sarah Boussetta (étudiante), Jean-Luc Faillie (Montpellier)
Le zilebesiran est un petit ARN interférent à double brin (siRNA) de longue demi-vie (le suffixe -iran permet d’identifier les médicaments de type à ARN interférents). Il agit en amont du système rénine-angiotensine-aldostérone (SRAA) en bloquant la synthèse hépatique de l’angiotensinogène. Pour cibler spécifiquement le foie, il est conjugué à une N-acétylgalactosamine (GalNAc), qui assure une internalisation efficace par les récepteurs asialoglycoprotéine (ASGPR) des hépatocytes et protège la molécule de la dégradation. L’action intracellulaire repose sur le clivage spécifiquement de l’ARN messager (ARNm) de l’angiotensinogène, réduisant ainsi sa traduction.
Cette approche présente plusieurs avantages théoriques par rapport aux inhibiteurs de l’enzyme de conversion de l’angiotensine (IEC) ou aux antagonistes des récepteurs de l’angiotensine II (ARA2). En ciblant le précurseur commun, elle pourrait limiter les phénomènes de contournement du SRAA observés avec ces classes. De plus, la délivrance hépatosélective préserve l’expression extra-hépatique d’angiotensinogène, ce qui pourrait réduire certains effets indésirables liés au blocage complet du SRAA au niveau rénal ou dans d’autres tissus.
La pharmacocinétique du zilebesiran est marquée par une très longue demi-vie, permettant d’envisager une administration sous-cutanée unique tous les 3 à 6 mois. Le zilebesiran est ainsi présenté comme solution pour lutter contre l’observance médicamenteuse sous-optimale des traitements antihypertenseurs quotidiens souvent en cause dans le mauvais contrôle tensionnel.
Les essais cliniques de phase 1 et 2 ont montré des résultats encourageants : une réduction dose-dépendante de la pression artérielle systolique et diastolique, persistante jusqu’à 24 semaines après une injection unique (1,2). Les effets indésirables rapportés sont principalement des réactions locales au point d’injection, quelques cas d’hyperkaliémie, d’hypotension et d’insuffisance rénale aiguë, sans survenue fréquente d’événements graves (considérés comme liés au traitement).
Un point de vigilance nouveau concerne l’effet antihypertenseur prolongé, qui pourrait poser un problème de sécurité dans des contextes aigus nécessitant une restauration rapide de la pression artérielle (choc, hypovolémie, interventions chirurgicales). Pour contourner ce risque, plusieurs stratégies sont explorées : l’administration de fludrocortisone, une supplémentation en sel ou encore l’utilisation d’un antidote spécifique : le ReversirTM, un oligonucléotide simple brin complémentaire du zilebesiran, capable d’annuler son effet en moins de 24 heures chez l’animal.
En conclusion, le zilebesiran constitue une innovation thérapeutique intéressante pour le traitement de l’HTA mais son efficacité et sa sécurité doivent encore être confirmées par des essais de phase 3 bien conduits.
- Bakris et al. RNA Interference With Zilebesiran for Mild to Moderate Hypertension: The KARDIA-1 Randomized Clinical Trial. JAMA. 2024 Mar 5;331(9):740-749.
- Desai et al. Add-On Treatment With Zilebesiran for Inadequately Controlled Hypertension: The KARDIA-2 Randomized Clinical Trial. JAMA. 2025 Jul 1;334(1):46-55.
Essai clinique simulé ou in silico, de quoi parle-t-on ?
Dalil Boulefaa et Margaux Lafaurie (Toulouse)
Un essai clinique simulé ou in silico est une simulation informatique d’un essai clinique, réalisé sans inclusion de patients ni utilisation de données observationnelles. Il est important de ne pas les confondre avec les essais cliniques émulés visant à reproduire les caractéristiques d’un essai cible sur des données observationnelles (BIP Occitanie n°4 2024).
Le terme in silico fait référence au silicium, composant des puces électroniques des ordinateurs, par opposition aux essais in vitro (en laboratoire) ou in vivo (sur des organismes vivants). Ces essais simulent l’évolution clinique et la réponse au traitement de patients « virtuels » ou « numériques » créés à l’aide de modèles computationnels (mathématiques et informatiques). Ces modèles sont construits à l’aide des connaissances et/ou hypothèses physiologiques, physiopathologiques, cliniques et pharmacologiques impliquées dans la maladie et la réponse au traitement, puis calibrés et validés à l’aide d’essais cliniques (bien réels ceux-ci) dont ils tentent de reproduire les résultats.
Un exemple : SIRIUS le programme d’essais cliniques in silico de l’inclisiran.
L’inclisiran est un médicament hypolipémiant, il s’agit d’un ARN interférant (siARN) anti-PCSK9, protéine responsable de la dégradation du récepteur hépatique au LDL-cholestérol. L'inclisiran est autorisé chez les patients ayant une hypercholestérolémie, dans le cadre d'une prévention cardiovasculaire primaire ou secondaire, quand l'effet des statines est jugé insuffisant ou quand celles-ci ne sont pas utilisables. Il s’administre en une seule injection sous-cutanée : une première fois, puis à 3 mois et enfin tous les 6 mois. L’évaluation de ce médicament repose sur plusieurs essais cliniques versus placebo avec pour critère de jugement un critère intermédiaire : la LDL-cholestérolémie. Il est donc légitime de s’interroger sur l’impact de ce médicament sur des critères cliniquement pertinents de morbi-mortalité.
Plusieurs essais cliniques « réels » (ORION-4 et VICTORION-2P, résultats attendus pour 2027) et le programme d’essais cliniques « simulés » SIRIUS (1) ont été conduits pour « répondre » à cette interrogation à 5 ans en prévention secondaire.
Le modèle computationnel de SIRUIS s’est basé sur les connaissances disponibles concernant la physiopathologie de l’athérosclérose, la prédiction à long terme du risque cardiovasculaire associé ainsi que la pharmacologie des hypolipémiants et l’impact des facteurs de risque individuels. Les essais cliniques de morbi-mortalité des anticorps anti-PCSK-9 ont notamment été utilisés pour valider le modèle.
Le premier essai « simulé » en prévention secondaire versus placebo a inclus 204 691 patients « virtuels » sous statine haute intensité +/- ézétimibe (sans aucun perdu de vue ni déviation au protocole !) (2). L’incidence cumulée des événements cardiovasculaires majeurs étaient de 11% sous inclisiran et 15% sous placebo. Le Hazard Ratio était de 0,75 (il n’y a pas d’intervalle de confiance mais un degré d’incertitude de la prédiction évaluée comme étant faible) avec un Nombre de Sujets à Traiter pendant 5 ans pour éviter un événement de 28. A noter qu’aucun critère de sécurité n’était inclus dans le programme SIRIUS !
La Commission de la Transparence de la HAS présente le programme SIRIUS comme « exploratoire » reposant sur une « construction hypothétique de la réalité » et sur « une prédiction non vérifiable de l’efficacité » (3).
Notre avis sur la place de ces essais simulés dans l’évaluation des médicaments
Ces essais cliniques simulés ou in silico n’ont pas vocation à fournir une preuve clinique formelle de l’efficacité d’un médicament, reposant sur une modélisation hypothétique des mécanismes physiopathologiques et pharmacologiques. Certaines données essentielles à la compréhension de ces mécanismes sont encore inconnues et il est de toute façon illusoire de vouloir capturer toute la complexité du vivant.
Cependant, ces essais offrent des perspectives intéressantes pour explorer le potentiel des candidats médicaments et/ou orienter la conception d’essais cliniques.
- Angoulvant D, et al. In-silico trial emulation to predict the cardiovascular protection of new lipid-lowering drugs: an illustration through the design of the SIRIUS programme. Eur J Prev Cardiol. 2024;31:1820-1830.
- Angoulvant D, et al. Predicting the efficacy of inclisiran on cardiovascular outcomes in patients with established atherosclerotic cardiovascular disease: Primary results of the in silico SIRIUS trial. Atherosclerosis. 2024;395:118409.
- Haute Autorité de Santé. Avis sur les médicaments. Inclisiran LEQVIO. Primo-inscription. Adopté par la Commission de la transparence le 28 août 2024.Disponible sur : https://www.has-sante.fr/upload/docs/evamed/CT-20782_LEQVIO_PIC_INS_AvisDef_CT20782.pdf Consulté le 26/08/2025.
MYDRIASES ACCIDENTELLES ET DISPOSITIFS TRANSDERMIQUES DE SCOPOLAMINE
Marilou Duboëlle (docteur junior), Virginie Bres (Montpellier)
Les atteintes ophtalmiques des médicaments systémiques sont souvent sous-estimées. Elles peuvent concerner toutes les structures oculaires : paupières et conjonctive suite à des toxidermies sévères (syndromes de Lyell ou de Stevens-Johnson), cornée notamment avec l’amiodarone, muscle ciliaire ou pupille avec certains antidépresseurs, cristallin avec la cataracte cortico-induite, rétine avec les antipaludéens de synthèse ou nerf optique avec l’éthambutol.
Mais au-delà des effets indésirables oculaires des traitements systémiques, typiquement bilatéraux, les troubles ophtalmiques peuvent également survenir lors d’un contact direct, y compris involontaire. Les mydriases observées au décours d’expositions accidentelles à la scopolamine transdermique (utilisée pour réduire les sécrétions salivaires en soins palliatifs) illustrent bien ce sujet. Ce sont des effets indésirables connus de la scopolamine, associés à son effet atropinique. Des asymétries pupillaires (anisocorie) ont été observées lors d'utilisation de scopolamine, elles semblent en rapport avec l'introduction accidentelle de substance active (en général laissée sur les doigts) directement dans l’un des yeux. Plusieurs observations concernant des patients ainsi que les soignants eux-mêmes ont été rapportées aux centres régionaux de pharmacovigilance. Dans tous les cas, les sujets concernés ont présenté une dilatation pupillaire unilatérale, associée ou non à des troubles visuels. Ces accidents, pouvant parfois évoquer à tort une urgence neurologique, sont survenus dans les heures suivant la manipulation des patchs de scopolamine. En général, la mydriase et ses symptômes éventuels disparaissent spontanément dans un délai de 48 à 72 heures. La prévention passe par une information claire des patients et soignants sur l’importance du lavage des mains après manipulation.
Price BH. Anisocoria from scopolamine patches. JAMA 1985;253:1561.
Lin YC. Anisocoria from transdermal scopolamine. Paediatr Anaesth 2001;11:626–7.
QUVIVIQ (DARIDOREXANT) ET PARALYSIE DU SOMMEIL : UN EFFET INDÉSIRABLE À CONNAÎTRE
Yasmine Soualy (interne en pharmacie), Virginie Bres (Montpellier)
Avez-vous déjà ressenti cette étrange impression d’être éveillé, conscient, mais incapable de bouger ou de parler, comme figé dans votre propre corps ? C’est l’expérience typique de la paralysie du sommeil, un trouble transitoire survenant à l’endormissement ou au réveil. Cette parasomnie se manifeste par une incapacité motrice de quelques secondes à minutes, due à la persistance de l’atonie musculaire du sommeil paradoxal. Elle peut s’accompagner d’une oppression thoracique, d’une sensation d’étouffement ou d’hallucinations hypnagogiques (à l’endormissement) ou hypnopompiques (avant le lever), pouvant être visuelles, auditives et tactiles. Bien que ce trouble puisse être inquiétant, il est sans gravité et fréquent (entre 20 % et 30 % de la population, en particulier les adolescents et les jeunes adultes).
Récemment commercialisé, le QUVIVIQ (daridorexant) est indiqué chez l’adulte dans le traitement de l’insomnie chronique. C’est un antagoniste des récepteurs des orexines 1 et 2. Les orexines sont des neuropeptides endogènes qui activent leurs récepteurs dans la région latérale hypothalamique. Cette stimulation participe au maintien de l’éveil, de la vigilance et de l’appétit. Le système orexinergique est donc essentiel à la régulation du cycle veille-sommeil. En le bloquant, le daridorexant favorise l’endormissement et le maintien du sommeil.
Dans une étude de phase III comparant daridorexant versus placebo(1), des comportements complexes du sommeil incluant paralysie du sommeil/hallucinations ont été rapportés (0,6% et 0,3% versus 0%). Ce risque est d’ailleurs mentionné dans le RCP. Depuis la commercialisation plusieurs dizaines de cas ont été enregistrés dans la base nationale de pharmacovigilance. Bien que bénigne, la paralysie du sommeil peut devenir une source d’anxiété. Il est important d’informer les patients avant l’instauration du traitement et déclarer les effets indésirables aux centres régionaux de pharmacovigilance.
Nouvelle surveillance pour les patients traités par clozapine
Pauline Schiro, François Montastruc (Toulouse)
En juillet 2025, le Comité européen d’évaluation des risques en matière pharmacovigilance (PRAC) a recommandé un assouplissement des règles de surveillance hématologique chez les patients traités par le neuroleptique antipsychotique clozapine (1-2).
Pour rappel, la clozapine est un antagoniste dopaminergique indiqué dans les cas de schizophrénie résistante et dans les troubles psychotiques liés à la maladie de Parkinson. Ce médicament expose à un risque connu de neutropénie et d’agranulocytose.
Précédemment, une numération formule leucocytaire était exigée chaque semaine durant les 18 premières semaines, puis au moins toutes les 4 semaines pendant toute la durée de la prise du médicament. Désormais, pour les patients sans antécédent de neutropénie, la surveillance devra être réalisée toutes les 12 semaines après 1 an, puis seulement 1 fois par an après 2 ans (contre toutes les 4 semaines auparavant).
Par ailleurs, en cas neutropénie légère (1-1.5 G/L), la surveillance devra être mensuelle durant tout le traitement médicamenteux et un arrêt définitif de la clozapine devra se faire en cas de neutrophiles < 1 G/L (1,5G/L auparavant).
Ces recommandations reposent sur des données montrant que le risque de neutropénie induite par la clozapine est principalement observé au cours de la première année, avec un pic d’incidence au cours des 18 premières semaines. Ensuite, l’incidence diminue, devenant progressivement plus faible après 2 ans de traitement chez les patients sans épisode antérieur de neutropénie.
Une étude a été réalisée sur une base de données de pharmacovigilance incluant 2,6 millions de NFS réalisées chez 26 000 patients sous clozapine, en Australie et en Nouvelle-Zélande, de 1990 à 2022. Elle retrouve que l’incidence cumulée de neutropénie grave entraînant un arrêt était de 0,9 % à 18 semaines et de seulement 1,4 % à 2 ans (3). Les résultats de cette étude concordent avec les données d’une méta-analyse portant sur 108 études et incluant 119 592 patients (4). Une autre méta-analyse, plus petite (36 études dont 23 provenant de Chine continentale), a abouti à des résultats similaires (5).
De plus, la surveillance repose désormais uniquement sur le nombre absolu de polynucléaires neutrophiles, un marqueur qui serait plus spécifique et pertinent du risque de neutropénie. Le suivi global des globules blancs n’est plus requis. Aussi, pour l’initiation, le seuil du nombre absolu de PNN passe d’un minimum 1.5 G/L contre 2 G/L précédemment.
Information de sécurité - Clozapine (Leponex et ses génériques) - ANSM
Northwood, K, Myles, N, Clark, SR, Every Palmer, S, Myles, H, Kisely, S, et al. Evaluating the epidemiology of clozapine-associated neutropenia among people on clozapine across Australia and aotearoa New Zealand: a retrospective cohort study. Lancet Psychiatry 2024; 11: 27–35.
Myles N, Myles H, Xia S, Large M, Kisely S, Galletly C, Bird R, Siskind D. Meta-analysis examining the epidemiology of clozapine-associated neutropenia. Acta Psychiatr Scand. 2018 Aug;138(2):101-109.
Li, XH, Zhong, XM, Lu, L, Zheng, W, Wang, SB, Rao, WW, et al. The prevalence of agranulocytosis and related death in clozapine-treated patients: a comprehensive meta-analysis of observational studies. Psychol Med 2020; 50: 583–94.
Ocrelizumab et maladie de Crohn
Haleh Bagheri (Toulouse)
L’ocrelizumab (OCREVUS) est un anticorps monoclonal anti-CD20 ayant obtenu une AMM européenne en 2018 dans la forme active de la sclérose en plaque. Plusieurs cas de colite immuno-médiées ou de maladie de Crohn ont été déclarés au niveau national en pharmacovigilance avec des délais de survenue variables allant de quelques semaines à quelques années. De même la littérature s’avère abondante sur le sujet (1-2). L’hypothèse évoquée serait la diminution des lymphocytes B jouant un rôle favorable dans le maintien de l’homéostasie immunitaire au niveau de la muqueuse intestinale par production de cytokines anti-inflammatoires (IL-10, IL-4, TGF-Beta) (3). Il s’agit d’un effet indésirable « inattendu » non libellé dans le Résumé des Caractéristiques du Produit (RCP) européen alors qu’il est signalé dans le RCP américain. Une demande antérieure pour rajouter cet effet indésirable au niveau du RCP européen n’a pas abouti et va être renouvelée… dans 3 ans. En attendant, ne pas oublier le lien entre la survenue d’une colite et l’exposition à l’ocrelizumab.
Kim T, Brinker A, Croteau D et al. Immune-mediated colitis associated with ocrelizumab. A newsafety risk. Mult Scler. 2023, 29(10) : 1275-81
Barnes A, Hofmann D, Hall LA, Klebe S, Mountifield R. Ocrelizumab-induced inflammatory bowel disease-like illness characterized by osophagitis and colitis. Ann gastroenterol 2021, 34(3) : 447-448.
- Quesada-Simo A, Garrido-Marin A, Nos P, Gil-Perotin S. Impact of Anti-CD20 therapies on the immune homeostasis of gastrointestinal mucosa and their relationship with de novo intestinal bowel disease in multiple sclerosis: a review. Front pharmacol. 2023
GLP-1 et risque de cancer chez les patients obèses
Jean-Luc Faillie (Montpellier)
Du fait de la perte pondérale importante qu’ils induisent, les agonistes du récepteur au GLP-1 (AR-GLP-1) pourraient contribuer à réduire le risque de certains cancers associés à l’obésité. C’est l’objet d’une étude observationnelle américaine publiée dans JAMA Oncology incluant plus de 43 000 patients obèses ou en surpoids traités par AR-GLP-1, appariés à un nombre identique de témoins non exposés. Les auteurs ont eu recours à une émulation d’essai clinique pour comparer les incidences de 13 types de cancers liés à l’obésité.
Les résultats suggèrent une réduction globale du risque de cancer de 17% dans le groupe AR-GLP-1, avec des baisses significatives pour les cancers de l’endomètre (-25%), de l’ovaire (-47%) et pour les méningiomes (-31%). En revanche, une tendance à une augmentation du risque de cancer du rein (+38%) a été observée, sans atteindre la significativité statistique. Ces données rejoignent celles déjà publiées dans des populations diabétiques, renforçant l’hypothèse d’un effet protecteur potentiel des AR-GLP-1 vis-à-vis de certains cancers.
Malgré la robustesse apparente de la méthodologie et l’ampleur de la cohorte, les limites inhérentes à ce type d’approche doivent être soulignées notamment le biais de confusion résiduelle : les patients traités par AR-GLP-1 peuvent différer des témoins sur des variables non mesurées et pouvant influencer le risque de cancer : statut socio-économique, habitudes alimentaires, activité physique, accès aux soins et autres facteurs de risque de cancer non mesurés.
À l’inverse de ces résultats plutôt rassurants, un signal de risque de cancer thyroïdien avec les AR-GLP-1 continue de susciter des interrogations. Cet effet a été initialement évalué mais non retenu par l’EMA, malgré un risque de cancer médullaire identifié chez l’animal et suggéré lors d’une étude pharmaco-épidémiologique française utilisant le SNDS. Cet été, une méta-analyse mise à jour des essais cliniques, menée en collaboration avec les équipes de pharmacologie de Montpellier et de Caen, a rapporté une augmentation significative de 62% du risque de cancers thyroïdiens toutes formes confondues (avec une incidence 0,5 pour 1000 personnes-années) (2). Dans ce contexte, sans remettre en question le rapport bénéfices/risques favorable, il paraît essentiel que ce risque potentiel soit a minima mentionné dans les informations officielles de ces médicaments, comme c’est déjà le cas aux États-Unis.
- Dai H, Li Y, Lee YA, et al. GLP-1 Receptor Agonists and Cancer Risk in Adults With Obesity. JAMA Oncol. Published online August 21, 2025. doi:10.1001/jamaoncol.2025.2681
- Duchemin L, Morice A, Morice PM, Bernardeau C, Alexandre J, Fedrizzi S, Da Silva A, Boismoreau L, Faillie JL, Dolladille C. Risk of thyroid cancer related to glucagon-like peptide-1 receptor agonists: A systematic review with meta-analysis of harms of randomized controlled trials. Diabetes Obes Metab. 2025 Aug;27(8):4607-4610.
Benzodiazépines et grossesse : pas de sur-risque démontré de troubles envahissants du développement chez l’enfant
Justine BENEVENT (Toulouse)
Les benzodiazépines figurent parmi les psychotropes les plus prescrits pendant la grossesse, mais leurs conséquences à long terme sur le développement de l’enfant restent mal connues. Nous avons analysé les données de la base EFEMERIS-RHE31, qui recense les naissances en Haute-Garonne et les expositions médicamenteuses des mères, en les reliant aux diagnostics de troubles envahissants du développement (TED) chez les enfants à 5 et 8 ans.
L’étude a porté sur 85 860 naissances entre 2004 et 2013. Parmi elles, 2 958 enfants (3,4 %) avaient été exposés in utero à une benzodiazépine, 1 535 (1,8 %) étaient nés de mères exposées uniquement avant la grossesse, et 81 367 (94,8 %) n’avaient connu aucune exposition. Au total, 32 cas de TED ont été recensés chez les enfants exposés pendant la grossesse, contre 16 et 501 dans les deux autres groupes.
Après analyses statistiques ajustées, aucun excès de risque significatif n’a été observé chez les enfants exposés in utero, comparés aux deux groupes témoins. La force de ce travail réside à la fois dans l’utilisation du registre du handicap de la Haute-Garonne, qui enregistre de façon exhaustive et validée médicalement tous les cas de TED sur le territoire, et dans le choix d’un groupe témoin constitué d’enfants de mères exposées uniquement avant la grossesse, ce qui permet de limiter le biais d’indication. Ces résultats sont donc rassurants pour les praticiens et les patientes, même si la prudence reste de mise compte tenu du faible nombre de cas et de la complexité des facteurs en jeu dans la survenue des troubles du neuro-développement.
La finance s’offre la santé publique
Bernard Bégaud (Bordeaux)
Existe-t-il plus bel exemple, plus beau succès de santé publique que celui de la vaccination ? Combien de centaines de millions de décès évités ? De maladies qui fauchaient autrefois des pans entiers de population et qui ont pratiquement disparu ? Un acte citoyen pour se protéger mais aussi protéger les autres. Le tout sans distinction de classe, une couverture accessible à tous ; bref, un rêve social absolu.
Ceci, c’était avant que les politiques sanitaires ne se couchent devant les intérêts des actionnaires des groupes pharmaceutiques. Avant que les prix, autrefois de quelques euros la dose, ne deviennent fous depuis que l’on a intelligemment mis dans le logiciel des décideurs la logique scandaleuse de la Health Technology Assessment (HTA, Évaluation des technologies de santé). Avec cette machine à perdre érigée en dogme consensuel, la valeur ajoutée des technologies de santé doit s’évaluer en considérant les conséquences (sous-entendez les bénéfices) de leur utilisation sur le long terme. Ainsi, si un vaccin évite de contracter la maladie X, il devient normal que son prix prenne en compte les coûts qu’aurait induits la maladie pour la société ou le système d’assurance : hospitalisations, bilans, traitements, séquelles, arrêts de travail, etc. À ce jeu, les vaccins contre la tuberculose, la poliomyélite et autres, au lieu de presque rien, auraient dû valoir des centaines ou des milliers d’euros la dose et notre système d’assurance maladie aurait explosé depuis longtemps.
La conséquence attendue et vérifiée est la mise en question, si ce n’est à mort, des deux principes de base de la vaccination : l’accès universel sans discrimination de revenu ni de classe sociale et l’immunisation la plus complète possible de la population pour faire tomber le risque de contamination à un niveau négligeable ou nul.
Personne ne semble trop s’en émouvoir ; pas même l’Organisation mondiale de la santé (OMS), un temps elle-même promotrice de l’approche HTA ! Cerise sur le gâteau, l’acte devient contraire à son principe fondateur : ce sont les personnes qui devraient être prioritairement protégées qui le sont in fine le moins.
Ainsi, une vaccination contre le papilloma virus, censée protéger, entre autres, du cancer du col utérin coute plus de 300 euros avec un reste à charge supérieur à 80 euros. Hypocritement, les responsables sanitaires, visiblement peu émus par le prix, expliquaient que le surcoût est « généralement » pris en charge par les mutuelles, les complémentaires santé. Bref, on fait comme si tout le monde pouvait souscrire un tel programme et si les remboursements ne se répercutaient pas sur les cotisations. Résultat : avant l’instauration de la campagne scolaire (à la réussite mitigée), ce sont les jeunes filles des classes sociales les plus défavorisées, celles qui risquent d’être les moins bien suivies médicalement, qui ont été les moins vaccinées. Un succès ! Un peu comme si au début du XXe siècle, la vaccination contre la tuberculose n’avait été accessible qu’aux privilégiés des beaux quartiers.
Plus fou encore : le prix du Beyfortus® (nirsévimab), vaccin ou, plus exactement, traitement préventif de la bronchiolite du nourrisson à virus respiratoire syncitial (VRS) ; 401,80 euros la dose, remboursée à seulement 30% par l’Assurance maladie, soit… 281 euros de reste à charge ! Là, le système a carrément dérapé : on nous martèle (en tout cas, depuis que le dit vaccin est disponible) que protéger les nourrissons des désastres de la bronchiolite est une priorité absolue de santé publique mais le produit n’est remboursé qu’à 30% (suite à un enthousiasme mitigé de la Haute Autorité de Santé) ; ceci après qu’on lui ait accordé un prix déraisonnable le réservant aux plus aisés. Qui s’en émeut ? Qui osera encore parler de santé « publique » ? Citons cependant la prise de position de la Société Française de Pédiatrie demandant que le remboursement soit porté à 65%, sans, visiblement, s’émouvoir ni même s’étonner du prix de base ahurissant. De toutes façons, 65% laisserait quand même aux parents 141 euros à débourser, ce qui ne changera pas fondamentalement le problème. Quant à l’État Providence, il devrait débourser 157 millions d’euros par an, sur la base de 600 000 nourrissons vaccinés. Mieux vaut ne pas relire la définition de la santé publique par l’OMS, il semble qu’elle appartienne déjà au passé.
Article publié le 28 novembre 2024 dans VIF Vieux, Inégaux et Fous
DÉRIVÉS ÉMERGENTS DE LA KÉTAMINE : ENTRE PHARMACOLOGIE INQUIÉTANTE ET ENCADREMENT RÉGLEMENTAIRE RENFORCÉ
Quentin Tourdot (externe), Arnaud Autellet (Interne), Margot Lestienne, Céline Eiden, Hélène Peyrière (Montpellier)
Le marché des nouvelles substances psychoactives (NPS) connaît une expansion rapide exploitant souvent les zones grises du cadre législatif. Parmi ces composés émergents, certains dérivés de la kétamine, tels que l’O-PCE (N-éthyldeschlorokétamine ou 2’-OXO-PCE ou éticyclidone), la 2-FDCK (2-fluorodeschloroketamine) et la DCK (deschlorokétamine ou 2’-OXO-PCM ou DXE), suscitent une inquiétude croissante en raison de leurs effets puissants, mal connus et parfois dangereux.
L’Agence Nationale de Sécurité du Médicament (ANSM) a récemment renforcé la régulation des dérivés de la kétamine en inscrivant la 2-FDCK sur la liste des stupéfiants en août 2024. Cette démarche a été suivie, fin juillet 2025, par l’ajout de la DCK et de l’O-PCE à cette même liste [1]. Cette classification vise à encadrer strictement la circulation de ces substances et à mieux protéger les usagers face à leur diffusion croissante.
Comme la kétamine, ces dérivés agissent principalement par antagonisme non compétitif des récepteurs NMDA, induisant des effets dissociatifs et hallucinogènes. Leur structure chimique, notamment le noyau cyclohexane, est à l’origine de ces effets psychédéliques. Ils possèdent également une activité stimulante, via l’inhibition de la recapture de la dopamine et une action agoniste partielle sur les récepteurs sérotoninergiques 5-HT2. Leur puissance est supérieure à celle de la kétamine et leurs demi-vies sont variées (par exemple 5 heures pour l’O-PCE, 69 minutes pour la 2-FDCK).
En France, une évaluation des risques par le réseau des centres d’addictovigilances sur la période 2017-2023 a permis d’analyser 39 cas d’effets indésirables liés à ces substances [2] :
- Forte augmentation des cas notifiés : de 1 en 2017 à 16 en 2023
- Substances impliquées : principalement la 2-FDCK, l’O-PCE et la DCK
- 66% des cas jugés sévères, dont 13 hospitalisations et 10 passages aux urgences, 4 patients admis en réanimation après usage concomitant d’autres NPS
- Profil : hommes (37/39), âge médian 29 ± 10 ans.
- Dans 10 cas, l’usage était à l’insu du consommateur qui pensait consommer :
- Un mélange kétamine et cocaïne dans 5 cas
- Une cathinone dans 5 cas
- Les effets indésirables sont principalement neurologiques et psychiatriques incluant des effets dissociatifs et des altérations de la conscience
- L’étude DRAMES a rapporté 3 décès, dont 2 directement imputables à la prise de ces substances
- Les profils de consommateurs sont variés, mais concernent souvent des usagers expérimentateurs de NPS et de dissociatifs
Il est crucial de sensibiliser les usagers et les professionnels à ces risques, notamment face à l’émergence de pratiques inquiétantes telles que la distribution par "box" mensuelle de NPS. La progression de l’usage de ces substances appelle une réponse rapide, coordonnée et multidisciplinaire, combinant veille toxicologique, actions législatives et prévention ciblée. Le manque de recul concernant les risques à moyen et long terme liés à l’usage des dérivés de la kétamine impose une vigilance renforcée.
Dérivés de la kétamine : l’ANSM classe de nouvelles substances sur la liste des stupéfiants. PUBLIÉ LE 05/08/2025. https://ansm.sante.fr/actualites/derives-de-la-ketamine-lansm-classe-de-nouvelles-substances-sur-la-liste-des-stupefiants
Pochard L, Lacroix C, Fouilhé N, Peyrière H, Micallef J. Nouveaux produits de synthèse dérivés de la kétamine : données du Réseau français d’addictovigilance. Thérapies. 2024 ;79(6):760. doi:10.1016/j.therap.2024.10.043.
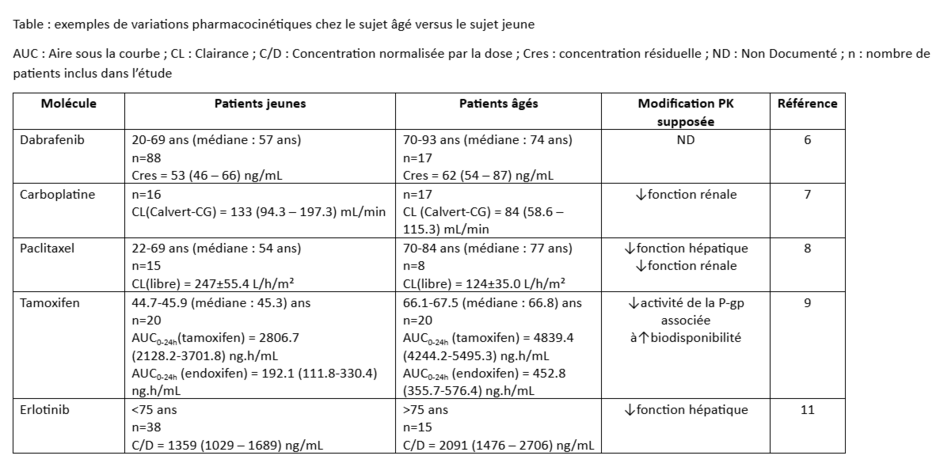
Impact du vieillissement sur la pharmacocinétique des anticancéreux
Manon Launay (Service de pharmacologie, Institut Curie), Peggy Gandia (Laboratoire de Pharmacocinétique et Toxicologie, CHU Toulouse)
Selon l’Institut national du cancer (INCa), 62,4 % des cancers surviennent chez des patients de plus de 65 ans (1). Pourtant, seuls 1,5 % des patients âgés de plus de 60 ans participent aux essais cliniques évaluant les anticancéreux (2). Les recommandations thérapeutiques reposent donc essentiellement sur des données issues de patients plus jeunes, sans refléter les particularités physiopathologiques du sujet âgé, ce qui est problématique pour des médicaments à marge thérapeutique étroite tels que les anticancéreux.
Chez le patient âgé, plusieurs modifications interviennent. La capacité métabolique hépatique diminue, en lien avec une réduction du volume du foie et de l’activité des cytochromes P450 (CYP1A2, CYP2B6, CYP2C19, CYP2E1, CYP2C9), dont l’activité peut être réduite d’environ 25 % (3-5). Par ailleurs, une altération de la fonction rénale est observée chez environ 60 % des sujets âgés, réduisant la clairance des médicaments éliminés par voie rénale. Par ailleurs, la présence de sarcopénie rend l’évaluation de la fonction rénale complexe, car la créatininémie peut apparaître faussement normale, conduisant à une surestimation de la clairance et donc à des posologies inadaptées¹⁰. Enfin, la diminution de l’activité de transporteurs tels que la P-glycoprotéine peut accroître la biodisponibilité orale de certains médicaments.
Face à ces enjeux, les cliniciens ajustent souvent les doses de manière empirique. Toutefois, le suivi thérapeutique pharmacologique constitue une alternative prometteuse pour individualiser les traitements. Le GPCO-UNICANCER met à disposition un annuaire recensant les laboratoires français réalisant ces dosages spécifiques (https://www.unicancer.fr/fr/les-groupes-d-experts/le-groupe-de-pharmacologie-clinique-oncologique/annuaire-gpco-dosage-danticancereux/).
1. Institut National du Cancer. Épidémiologie des cancers chez les patients de 65 ans et plus - Oncogériatrie. 2018. Available at: www.e-cancer.fr/Professionnels-de-sante/L-organisation-de-l-offre-de-soins/Oncogeriatrie/Epidemiologie. Accessed October 11, 2024.
2. Zhao S, Miao M, Wang Q, Zhao H, Yang H, Wang X. The current status of clinical trials on cancer and age disparities among the most common cancer trial participants. BMC Cancer. 2024 Jan 2;24(1):30. doi: 10.1186/s12885-023-11690-9. PMID: 38166779; PMCID: PMC10763089.
3. Kinirons MT, O'Mahony MS. Drug metabolism and ageing. Br J Clin Pharmacol. 2004 May;57(5):540-4. doi: 10.1111/j.1365-2125.2004.02096.x. PMID: 15089805; PMCID: PMC1884487.
4. Parkinson A, Mudra DR, Johnson C, Dwyer A, Carroll KM. The effects of gender, age, ethnicity, and liver cirrhosis on cytochrome P450 enzyme activity in human liver microsomes and inducibility in cultured human hepatocytes. Toxicol Appl Pharmacol. 2004 Sep 15;199(3):193-209. doi: 10.1016/j.taap.2004.01.010. PMID: 15364537.
5. Tanaka E. In vivo age-related changes in hepatic drug-oxidizing capacity in humans. J Clin Pharm Ther. 1998 Aug;23(4):247-55. doi: 10.1046/j.1365-2710.1998.00164.x. PMID: 9867310.
6. Crombag MBS, van Doremalen JGC, Janssen JM, Rosing H, Schellens JHM, Beijnen JH, Steeghs N, Huitema ADR. Therapeutic drug monitoring of small molecule kinase inhibitors in oncology in a real-world cohort study: does age matter? Br J Clin Pharmacol. 2018 Dec;84(12):2770-2778. doi: 10.1111/bcp.13725. Epub 2018 Sep 26. PMID: 30068020; PMCID: PMC6256014.
7. Merino-Sanjuán M, Monteiro JF, Porta-Oltra B, Maestu I, Almenar D, Jiménez-Torres NV. Effect of age on systemic exposure and haematological toxicity of carboplatin in advanced non-small cell lung cancer patients. Basic Clin Pharmacol Toxicol. 2011 Dec;109(6):457-64. doi: 10.1111/j.1742-7843.2011.00753.x. Epub 2011 Aug 8. PMID: 21726412.
8. Smorenburg CH, ten Tije AJ, Verweij J, Bontenbal M, Mross K, van Zomeren DM, Seynaeve C, Sparreboom A. Altered clearance of unbound paclitaxel in elderly patients with metastatic breast cancer. Eur J Cancer. 2003 Jan;39(2):196-202. doi: 10.1016/s0959-8049(02)00611-1. PMID: 12509952.
9. Ximenez JPB, de Andrade JM, Marques MP, Coelho EB, Suarez-Kurtz G, Lanchote VL. Hormonal status affects plasma exposure of tamoxifen and its main metabolites in tamoxifen-treated breast cancer patients. BMC Pharmacol Toxicol. 2019 Dec 19;20(Suppl 1):81. doi: 10.1186/s40360-019-0358-y. PMID: 31852530; PMCID: PMC6921430.
10. Launay M, Vogrig M, Damin-Pernik M, Marotte H, Perinel-Ragey S. Misleading Renal Function Evaluation Leading to Severe Methotrexate-Induced Toxicity. Ther Drug Monit. 2025 Apr 1;47(2):196-198. doi: 10.1097/FTD.0000000000001297. Epub 2024 Dec 17. PMID: 39688254.
11. Bigot F, Boudou-Rouquette P, Arrondeau J, Thomas-Schoemann A, Tlemsani C, Chapron J, Huillard O, Cessot A, Vidal M, Alexandre J, Blanchet B, Goldwasser F. Erlotinib pharmacokinetics: a critical parameter influencing acute toxicity in elderly patients over 75 years-old. Invest New Drugs. 2017 Apr;35(2):242-246. doi: 10.1007/s10637-016-0400-5. Epub 2016 Oct 29. PMID: 27796680.

BIP Occitanie fait partie de l'International Society of Drug Bulletins (ISDB)