BIP 2025 N°4

Editorial
Quelle logique pour l’octroi d’une Autorisation d’Accès Compassionnel ? (AAC)
L’autorisation d’accès compassionnel est un dispositif permettant l’utilisation, à titre exceptionnel, d’un médicament dans une indication précise en l’absence d’autorisation de mise sur le marché (AMM) en France, quelle que soit l'indication thérapeutique, dès lors que toutes les conditions suivantes sont remplies : la maladie est grave, rare ou invalidante ; il n’existe pas de traitement approprié; l’efficacité et la sécurité de ce médicament, pour l’indication considérée, sont présumées favorables au regard des données cliniques… A noter que les médicaments en AAC sont pris en charge à 100% par la Sécurité Sociale.
Néanmoins, la consultation de la liste des médicaments en AAC laisse parfois dubitatif pour certains d’entre eux. Exemple : la flunarizine alias Sibelium. Ce médicament, un antagoniste calcique et appartenant aux deux classes thérapeutiques des antivertigineux et antimigraineux, a eu sa première AMM début des années 80 dans l’indication « Traitement de fond de la migraine lorsque les autres thérapeutiques sont inefficaces ou mal tolérées » chez l’adulte et l’enfant à partir de 10 ans. La dernière évaluation par la Haute Autorité de Santé a conclu à un Service Médical Rendu faible avec un remboursement à 15%. Inutile de rappeler que ce médicament a donné lieu à des enquêtes de pharmacovigilance avec un lien clair établi entre le syndrome parkinsonien, un effet indésirable grave et l’exposition à la flunarizine. La consultation du site de l’ANSM permet de savoir que la flunarizine CF 5 mg est fabriquée en Hollande (Laboratoire Centrafarm BV) et distribuée en France via une demande d’AAC dans les indications « migraine » et « vertige vestibulaire ». Heureusement, on retrouve dans les critères d’octroi, l’absence d’un syndrome parkinsonien ou extra-pyramidal !
Information manquante : le nombre annuel de demandes d’AAC pour ce médicament…
Dr Haleh BAGHERI
CHU Montpellier
Service de Pharmacologie Médicale et Toxicologie
Dr Olivier MATHIEU
Hôpital Lapeyronie, 371 Avenue du Doyen Gaston Giraud, 34295 Montpellier, France
Centre Régional de Pharmacovigilance (CRPV)
Déclaration en ligne : https://signalement.social-sante.gouv.fr/
Centre d’Addictovigilance
Laboratoire de Toxicologie et de Suivi Thérapeutique Pharmacologique
CHU Toulouse
Service de Pharmacologie Médicale et Clinique
Pr Agnès Sommet
37 allées Jules-Guesde, 31000 Toulouse, France
Centre Régional de Pharmacovigilance, de PharmacoEpidémiologie et d’Informations sur le Médicament (CRPV)
Centre d’Evaluation et d’Informations sur la Pharmacodépendance et d'AddictoVigilance (CEIP-A)
Antenne Médicale de Prévention du Dopage et des conduites dopantes d’Occitanie (Centre Pierre-Dumas)
Evaluation chez la Femme Enceinte des MEdicaments et de leurs RISques (EFEMERIS)
VOTRE SERVICE DE PHARMACOLOGIE MEDICALE
Les pharmacologues médicaux sont des spécialistes du médicament, médecins et pharmaciens, qui ont pour missions l’évaluation et le suivi de l’efficacité et de la sécurité des médicaments, les vigilances associées aux médicaments et aux drogues, l’information sur le bon usage du médicament et l’enseignement de la pharmacologie médicale auprès des étudiants en santé et des professionnels de santé. Les services de pharmacologie médicale et toxicologie des CHU de Montpellier et de Toulouse regroupent plusieurs structures médicales : centres régionaux de pharmacovigilance et d’information sur le médicament, centres d’addictovigilance, laboratoires de toxicologie et de suivi thérapeutique pharmacologique, unités de pharmacologie clinique et pharmaco-épidémiologie et unité de prévention du dopage.
Sommaire
- INFORMATIONS IMPORTANTES - ALERTES
- PHARMACOLOGIE CLINIQUE
- PHARMACOVIGILANCE
- PHARMACO-EPIDEMIOLOGIE
- MEDICAMENTS, REPRODUCTION ET PERINATALITE
- PHARMACOLOGIE SOCIALE
- ECOPHARMACOLOGIE
- ADDICTOVIGILANCE
Informations importantes et alertes concernant le bon usage et la sécurité des médicaments
ANSM
Gliflozines (dapagliflozine et empagliflozine) : prévenir les risques d’acidocétose diabétique et de gangrène de Fournier (fasciite nécrosante périnéale) (MàJ 24/09/2025) : lien
Médicaments à base de finastéride ou de dutastéride – Nouvelles mesures pour réduire le risque d'idées suicidaires (25/09/2025) : lien
Ambisome liposomal 50 mg et Fungizone 50 mg injectable : attention, ces deux spécialités ne sont pas interchangeables (06/10/2025) : lien
Médicament à base de nicorandil : Rappel sur le risque d’ulcérations, les interactions médicamenteuses (avec les AINS, l’aspirine et les corticoïdes) et l’arrêt du traitement en cas de signes évocateurs (12/11/2025) : lien
Les collyres d’atropine 0,5% peuvent être utilisés avec prudence chez les nourrissons et les enfants de moins de 3 ans (24/09/2025) : lien
Il n'existe pas de lien démontré entre le paracétamol et l'autisme (01/10/2025) : lien
Médicaments à base de lévothyroxine : Euthyrox sera disponible jusqu’à fin 2028 (01/10/2025) : lien
Réduire l'impact environnemental des médicaments : la France est mobilisée aux côtés de l’Europe (21/11/2025) : lien
Allonger la durée de conservation des médicaments dans un objectif de réduction du gaspillage et de la pollution (21/11/2025) : lien
- L’impact environnemental des médicaments est abordé dans la nouvelle rubrique écopharmacologie de ce numéro
Arrêt de commercialisation de Vitamine A Dulcis (pommade ophtalmique) : nouvelles alternatives (24/10/2025) : lien
Injections illégales de toxine botulinique : ne mettez pas en danger votre santé (23/10/2025) : lien
Valproate et dérivés : réduire le risque de troubles neurodéveloppementaux chez les enfants dont le père a été traité avant la conception (0611/2025) : lien
Point de situation sur l’approvisionnement en médicaments psychotropes en France au 6 novembre 2025 (10/11/2025) : lien
Semaine mondiale de sensibilisation à la résistance aux antimicrobiens : la collaboration entre les acteurs se poursuit pour lutter de manière efficace contre l’antibiorésistance (18/11/2025) : lien
L’ANSM prend des mesures de police sanitaire à l’encontre des sites internet vendant des aGLP-1 (19/11/2025) : lien
Les rapports de pharmacovigilance des traitements préventifs contre le VRS confirment leur sécurité (27/11/2025) : lien
Vaccins à ARNm contre le Covid-19 : ils n’augmentent pas le risque de mortalité à long terme (04/12/2025) : lien
EMA
Tegretol (carbamazépine) : restriction d’utilisation chez les nouveau-nés en raison de la concentration d’un excipient, le propylène glycol, dépassant le seuil recommandé (05/09/2025) : lien
Remsima (infliximab) : nouvelle formulation intraveineuse contre-indiquée chez les patients atteints d’intolérance héréditaire au fructose (05/09/2025) : lien
Crysvita (burosumab) : nouvelles recommandations de surveillance en raison du risque d’hypercalcémie sévère (05/09/2025) : lien
Caspofungine : nouvelle mise en garde concernant l’utilisation de membranes dérivées du polyacrylonitrile pendant la thérapie de remplacement rénal continue (hémofiltration continue) (05/09/2025) : lien
Acide tranexamique injectable : effets indésirables graves liés à une administration par erreur par voie intrathécale (31/10/2025) : lien
SFPT
Antagonistes des récepteurs minéralocorticoïdes et patients dialysés chroniques : vers la fin d’un débat ? (15/09/2025) : lien
Aggravation par l’aspirine, associée aux anticoagulants, de la morbi-mortalité cardiovasculaire et du risque hémorragique chez des patients présentant un syndrome coronarien chronique et un haut risque ischémique résiduel (29/09/2025) : lien
Paracétamol au cours de la grossesse et risque d’autisme chez l’enfant à naître (01/10/2025) : lien
VACCINS ARNm ET SENSIBILISATION TUMORALE AUX INHIBITEURS DES POINTS DE CONTROLE IMMUNOLOGIQUE (ICI)
Pascale Palassin (Montpellier)
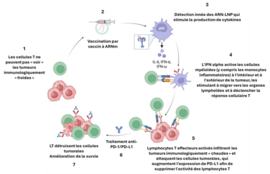
Difficile d’être passé à côté de cette étude, parue dans Nature le 22 octobre dernier, largement relayée depuis (1). Bien que s’appuyant sur des données cliniques rétrospectives et des modèles animaux, les résultats de cette étude suggèrent qu’une vaccination par un vaccin à ARNm dans les 100 jours précédant le début d’une immunothérapie par inhibiteurs des points de contrôle immunitaire (ICI) pourrait améliorer la réponse à ces traitements. Les ICI (anti-CTLA-4, anti-PD-1, anti-PD-L1 et plus récemment anti-LAG3, anti-TIGIT) ont révolutionné la prise en charge de très nombreux cancers. Toutefois, une proportion de patients reste non répondeuse, en lien notamment avec un micro-environnement tumoral immunosuppresseur et une faible expression tumorale de PD-L1 (tumeurs immunologiquement « froides »).
L’effet de vaccins à ARNm déjà disponibles (dirigés contre la protéine spike du SARS-CoV-2), au-delà des vaccins antitumoraux en cours de développement, a ainsi été testée. L’étude clinique rétrospective a comparé des patients atteints de cancer bronchique non à petites cellules (CBNPC) ou de mélanome, traités par ICI et vaccinés ou non par ARNm anti-SARS-CoV-2 dans les 100 jours précédant l’immunothérapie. Les résultats montrent une amélioration nette de la survie globale des patients atteints de CBNPC (survie globale à 3 ans 30,8 % versus 55,7 %, HRajusté 0,51 ; IC95% 0,37-0,71) et de mélanome (survie globale à 3 ans 44,1 % vs 67,6 % ; HRajusté 0,37 ; IC95% 0,18-0,74). Ces bénéfices n’ont en revanche pas été observés avec des vaccins non ARNm (grippe, pneumocoque) ou encore chez des patients vaccinés par vaccins à ARNm anti-SARS-CoV-2 mais traités par chimiothérapie. Par ailleurs, l’analyse de cohortes de biopsies tumorales a montré une augmentation significative du taux d’expression de PD-L1 (TPS) après une vaccination ARNm, modifiant potentiellement l’éligibilité thérapeutique de certains patients. D’après les résultats obtenus chez l’animal, les vaccins à ARNm, encapsulés dans des nanoparticules lipidiques, stimuleraient, indépendamment de l’antigène codé, la production de cytokines antivirales, notamment l'IFNα, entraînant une activation de l’immunité innée (cellules présentatrices de l’antigène). Les cellules immunitaires innées résidant dans la tumeur, activées par cette poussée de cytokines, prépareraient les lymphocytes T à s'activer et infiltrer les tumeurs. Bien que les cellules tumorales échappent à l'attaque en régulant à la hausse l'expression du PD-L1 (évaluée sur des cohortes de biopsies tumorales), l'association d’un ICI aux vaccins à ARNm permettrait de surmonter cette réponse compensatoire, provoquant une régression tumorale et une amélioration de la survie.
La réponse immunitaire innée à la vaccination par un vaccin à ARNm pourrait ainsi réinitialiser la réponse immunitaire anticancéreuse et préparer la réponse immunitaire adaptative pour une action synergique avec les ICI. Ceci suppose que l’efficacité de l’immunothérapie anticancéreuse pourrait dépendre davantage d’un stimulus antigénique puissant que de la seule charge mutationnelle initiale de la tumeur (2). Ces résultats pourraient représenter une avancée majeure dans la prise en charge des cancers, s’ils venaient à être confirmés par des essais cliniques randomisés.
Références
- Grippin AJ, et al. SARS-CoV-2 mRNA vaccines sensitize tumours to immune checkpoint blockade. Nature. 2025 Nov;647(8089):488-497.
- Qdaisat S, et al. Sensitization of tumours to immunotherapy by boosting early type-I interferon responses enables epitope spreading. Nat Biomed Eng. 2025 Sep;9(9):1437-1452.
Réactions anaphylactiques lors d’une première perfusion de cétuximab : évitables mais non évitées
Romain Barus- Toulouse
Nous avons récemment reçu le cas d'un patient qui a présenté une réaction anaphylactique dans les suites d'une première administration de cétuximab, anticorps monoclonal dirigé contre le récepteur du facteur de croissance épidermique (EGFR). A posteriori, un dosage des anticorps IgE anti-cetuximab (alpha-1-3-galactose) a été réalisé, retrouvant un taux élevé de ces anticorps.
Si tous les médicaments peuvent induire des réactions anaphylactiques, ce risque est fortement majoré avec le cétuximab « chez les patients présentant des antécédents d'allergie à la viande rouge ou aux morsures de tique ou présentant des résultats positifs aux anticorps anti alpha – 1-3-4 galactose » comme indiqué dans la monographie de ce médicament dans la rubrique 4.4 Mises en garde spéciales et précautions d’emploi.
Dans la littérature, l'incidence des réactions d'hypersensibilité immédiate au cétuximab concernerait entre 1,2 à 22 % des patients (1). Il s'agit donc d'un effet indésirable fréquent voir très fréquent. Les anticorps IgE se fixe sur la partie Fab (l’épitope correspondant à l’alpha gal) des chaînes lourdes du cétuximab et entrainent une réaction anaphylactique. L’alpha gal est un sucre qui n’est plus présent chez l’humain mais est retrouvé dans les muscles, les organes et la gélatine des mammifères non primate. De plus, certaines tiques expriment également l'alpha gal dans leur salive. L'hypersensibilité au cétuximab affecterait donc les sujets sensibilisés préalablement par de la viande (en cas de réaction allergique) ou par des morsures de tiques (2).
Le dépistage systématique de ces anticorps n’est pas réalisé en routine. La question de l'intérêt d'un tel dépistage se pose vu l'incidence élevée de ces réactions d'hypersensibilité immédiate. Ce dépistage systématique s’inscrirait dans une logique de prévention similaire à celle du dépistage du déficit en dihydropyrimidine déshydrogénase avant l’administration de fluoropyrimidines comme le 5-fluorouracile ou la capécitabine. Pour ces derniers, le dépistage est désormais obligatoire afin de réduire le risque d’effets indésirables graves et fait même partie de la liste actualisée des Never Events publiée dans le Bulletin officiel santé du 31 mai 2024 (3).
1. Piroth, M. et al. Hypersensibilité immédiate au cétuximab : une prévention reposant sur la recherche des IgE anti-alpha-gal ? Ann. Dermatol. Vénéréologie - FMC5, A347 (2025).
2. Hypersensibilité au cétuximab et réaction croisée ? RFCRPVwww.rfcrpv.fr/hypersensibilite-au-cetuximab-et-reaction-croisee/.
3. Actualité - La liste des « never events » est actualisée. ANSMansm.sante.fr/actualites/la-liste-des-never-events-est-actualisee.
Triple association rélugolix + estradiol + acétate de noréthistérone (RYEQO®) : un cocktail à risque suicidaire
Pauline Schiro-Toulouse
Depuis mars 2025, l’association rélugolix–estradiol–acétate de noréthistérone (RYEQO®) dispose d’une autorisation de mise sur le marché (AMM) pour traiter les symptômes de l’endométriose après échec d’un traitement médicamenteux ou chirurgical. Cette indication repose surtout sur deux essais randomisés, en double aveugle contre placebo, et non versus traitement hormonal. Ce médicament avait déjà une AMM dans les fibromyomes utérins.
Le rélugolix est un antagoniste de la GnRH induisant une hypoestrogénie similaire à celle de la ménopause. L’ajout d’estradiol et d’acétate de noréthistérone vise à atténuer les symptômes climatériques. Ainsi, l’association expose des femmes non ménopausées aux effets indésirables combinés d’une hypoestrogénie et d’un traitement hormonal substitutif, avec un risque thromboembolique.
Dans les essais cliniques, les effets indésirables les plus fréquents étaient des symptômes de transition ménopausique : bouffées de chaleur, sécheresse vaginale, baisse de la libido. Des troubles de l’humeur, y compris des épisodes dépressifs et des idées suicidaires, ont également été observés : 8 % des patientes sous RYEQO® contre 6 % sous placebo (1). Fait notable, le résumé des caractéristiques du produit européen ne mentionne pas le risque d’idées suicidaires, contrairement à celui des USA le signalant explicitement (2,3).
Une requête de la base française de pharmacovigilance a identifié deux cas d’idées suicidaires, survenus chez des patientes de 45 et 37 ans suivies pour endométriose, dans le premier mois suivant l’introduction du médicament. Au niveau de la base mondiale, on recense 53 cas de dépression ou d’humeur dépressive, 11 cas d’idées suicidaireset2 tentatives de suicide.
Si cette association constitue une alternative thérapeutique supplémentaire dans la prise en charge de l’endométriose, le risque de troubles de l’humeur et d’idées suicidaires mérite une attention particulière. Une information claire, une surveillance psychiatrique et une réévaluation régulière du rapport bénéfice-risque sont essentielles chez ces patientes déjà fragilisées par la chronicité et l’impact psychologique de la maladie.
- Giudice, Linda C et al. “Once daily oral relugolix combination therapy versus placebo in patients with endometriosis-associated pain: two replicate phase 3, randomised, double-blind, studies (SPIRIT 1 and 2).” Lancet (London, England) vol. 399,10343 (2022): 2267-2279.
- https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/214846s002lbl.pdf
- https://www.ema.europa.eu/fr/documents/product-information/ryeqo-epar-product-information_fr.pdf
Triméthoprime : quand traiter une cystite mène à des hallucinations
Lucie Blanchard (interne), Marilou Duboëlle et Véronique Simon (Montpellier)
Un effet indésirable non mentionné dans le Résumé des Caractéristiques du Produit (RCP) du triméthoprime (Delprim®) a fait l’objet d’un signalement récent. Il s’agit de la survenue d’hallucinations visuelles chez une patiente de 76 ans, apparues une heure après la prise d’un seul comprimé prescrit pour une cystite. Amenée aux urgences, la patiente a bénéficié d’un scanner cérébral, revenu strictement normal. Les symptômes ont disparu spontanément dès le lendemain, sans modification de son traitement habituel, qui comprenait l’escitalopram et l’aflibercept (Eylea®).
À ce jour, les hallucinations sont mentionnées comme un effet indésirable rare dans le RCP du Bactrim, spécialité associant sulfaméthoxazole et triméthoprime (SMX-TMP), mais elles ne figurent pas dans celui du triméthoprime seul. La littérature scientifique rapporte essentiellement des cas liés à l’association SMX-TMP (1). Les facteurs de risque évoqués incluent l’âge avancé, les antécédents psychiatriques et l’immunodépression. Le SMX-TMP franchit la barrière hématoencéphalique et diffuse largement et rapidement dans le liquide céphalo-rachidien, ce qui pourrait expliquer la survenue de manifestations neuropsychiques. Quant au triméthoprime, son action inhibitrice de la dihydrofolate réductase réduit la formation de tétrahydrofolate, forme active de l’acide folique, indispensable à la synthèse de l’ADN. Or, les carences en acide folique sont associées à des troubles neuropsychiatriques tels que la démence, la dépression ou des troubles cognitifs (2,3). Dans le cas de cette patiente, il aurait ainsi été intéressant de doser l’acide folique sanguin.
La chronologie des faits et l’absence d’autres causes identifiées rendent cet effet indésirable vraisemblablement imputable au triméthoprime. Ce signal mérite d’être connu et surveillé, en particulier chez les patients âgés.
Références :
- Stuhec M. Trimethoprim-sulfamethoxazole-related hallucinations. Gen Hosp Psychiatry. 2014 Mar-Apr;36(2):230.e7-8. doi: 10.1016/j.genhosppsych.2013.10.016.
- Iqbal KM, Luke PK, Ingram MT. Psychosis resulting from trimethoprim-sulfamethoxazole treatment for preseptal cellulitis. Taiwan J Ophthalmol. 2020 Dec 2;12(2):223-226. doi: 10.4103/tjo.tjo_66_20.
- Reynolds EH. La neurologie de la carence en acide folique. Handb Clin Neurol. 2014;120:927–943. doi: 10.1016/B978-0-7020-4087-0.00061-9.
Opioïdes et cancer : étude de cohorte et randomisation mendélienne
Jean-Luc Faillie (Montpellier)
L’opium brut est considéré comme cancérogène notamment pour les cancers du poumon, du pancréas et de la vessie. Une étude internationale publiée dans eClinicalMedicine a cherché à déterminer si les médicaments opioïdes partagent ce risque (1).
Les auteurs ont utilisé la cohorte UK Biobank qui regroupe plus de 500 000 adultes britanniques âgés de 40 à 69 ans lors de leur inclusion entre 2006 et 2010, suivis en médiane pendant 12,5 ans. Parmi les 472 955 participants analysés, 5,8 % déclaraient un usage régulier d’opioïdes (hors anesthésie). L’étude combine une analyse observationnelle classique de cette cohorte et une analyse génétique innovante par randomisation mendélienne.
La randomisation mendélienne est une méthode d’épidémiologie génétique qui utilise des variants génétiques comme instruments pour estimer l’effet causal d’une exposition (ici la consommation d’opioïdes) sur un événement (ici le cancer). Elle repose sur le principe que les allèles sont distribués aléatoirement à la conception, selon les lois de Mendel. Si un variant génétique est associé à une plus forte probabilité d’utiliser des opioïdes, on peut comparer le risque de cancer des personnes qui ont ces variants à celles qui ne les ont pas, comme si on les avait randomisés. En théorie, les biais sont réduits car un génotype associé à l’exposition ne devrait pas être lié à d’autres facteurs (de confusion) et n’affecte a priori le résultat que via l’exposition. La limite majeure de cette approche est que les gènes étudiés doivent être très spécifiques de l’exposition, ce qui est difficile à démontrer.
Les résultats de cette étude suggèrent que l’usage régulier d’opioïdes est associé à une augmentation de 33% du risque combiné pour les cancers liés à l’opium (poumon, pancréas, vessie, œsophage et larynx), indépendamment du tabagisme. Le risque augmente avec la puissance des opioïdes (+86% pour les forts) et avec la durée d’action. Aucun signal n’est observé pour sept cancers non liés à l’opium et les analyses génétiques par randomisation mendélienne sont cohérentes avec les données observationnelles.
Ces résultats doivent évidemment être interprétés avec prudence. La randomisation mendélienne n’offre pas le niveau de preuve d’un essai randomisé (qui serait ici irréalisable pour des raisons éthiques). Ces résultats doivent donc être confirmés et reproduits dans d’autres populations. Toutefois, même une élévation modérée du risque pourrait avoir un impact notable au vu de l’usage croissant des opioïdes. Il reste donc raisonnable dans tous les cas de limiter les prescriptions prolongées d’opioïdes.
Paracétamol pendant la grossesse et troubles du neurodéveloppement : où en est-on ?
Justine Benevent (Toulouse)
Le paracétamol est largement utilisé pendant la grossesse et plusieurs études épidémiologiques ont évoqué un possible lien entre exposition prénatale et troubles du neurodéveloppement, notamment troubles du spectre de l’autisme et TDAH. La plupart rapportent un léger sur-risque, mais leur grande hétérogénéité méthodologique incite à la prudence lors de l’interprétation de ces résultats. De nombreux biais potentiels influencent en effet les résultats. La classification de l’exposition reste approximative, le paracétamol étant souvent pris en automédication. Le biais d’indication est également déterminant : fièvre ou douleur motivent la prise, mais celle-ci est aussi plus fréquente chez les femmes présentant anxiété, dépression ou troubles psychiatriques, facteurs eux-mêmes associés à un risque accru de troubles du neurodéveloppement chez l’enfant. Une analyse quantitative récente suggère que ces biais et confusions non mesurées pourraient expliquer une grande partie de l’association observée (1). Une revue récemment publiée dans le BMJ apporte un éclairage supplémentaire en évaluant la qualité globale des données, jugée faible (2). Les auteurs se sont donc concentrés sur les études dites sibling, qui comparent des frères et sœurs discordants pour l’exposition afin de contrôler les facteurs familiaux, environnementaux et génétiques partagés. Ces études, plus robustes, ne mettent pas en évidence d’association entre exposition prénatale au paracétamol et troubles du neurodéveloppement. À ce jour, les données les plus fiables ne soutiennent donc pas l’existence d’un risque accru de troubles du neurodéveloppement après exposition prénatale au paracétamol.
- Masarwa R, Platt RW, Filion KB. Acetaminophen use during pregnancy and the risk of attention deficit hyperactivity disorder: A causal association or bias? Paediatr Perinat Epidemiol. 2020 May;34(3):309-317.
- Sheikh J, Allotey J, Sobhy S, Plana MN, Martinez-Barros H, Naidu H, Junaid F, Sofat R, Mol BW, Kenny LC, Gladstone M, Teede H, Zamora J, Thangaratinam S. Maternal paracetamol (acetaminophen) use during pregnancy and risk of autism spectrum disorder and attention deficit/hyperactivity disorder in offspring: umbrella review of systematic reviews. BMJ. 2025 Nov 9;391:e088141.
Cariban® et Xonvea® (doxylamine, pyridoxine) et grossesse : prudence en cas d’utilisation prolongée jusqu’au terme
Marie-Andrée Thompson-Bos, Montpellier
CARIBAN® et XONVEA® sont deux spécialités à base de doxylamine, en association avec la pyridoxine ou vitamine B6, dosage de 10/10 mg ou 20/20 mg), indiquées spécifiquement dans les nausées/vomissements de la grossesse. Il existe aussi une spécialité plus ancienne DONORMYL® (cps à 15 mg) (doxylamine seule), en vente libre, indiquée dans l’insomnie occasionnelle de l’adulte.
La doxylamine est un antihistaminique-H1, qui possède un effet sédatif et un effet anticholinergique. Sa demi- vie est de 10h, soit une élimination en 3 jours environ chez l‘adulte (attendue prolongée chez le nouveau-né). Son utilisation est bien documentée au cours de la grossesse, notamment car elle est utilisée depuis de nombreuses années dans les pays anglo-saxons pour traiter les nausées de la grossesse, mais l’AMM est relativement récente en France.
La doxylamine peut en théorie être utilisée quel que soit le trimestre de la grossesse mais une utilisation prolongée et près du terme peut être responsable de manifestations d’imprégnation chez le nouveau-né se traduisant par des troubles digestifs et/ou neurologiques (retard à l'émission du méconium, difficultés de mise en route de l’alimentation, agitation, tachycardie, trémulations et sédation). Comme la plupart des effets d’imprégnation à un médicament reçu in utero, ces effets ne sont pas systématiques, dans leur très grande majorité sans gravité et cèdent spontanément avec l’élimination du médicament.
Notons cependant le cas d’un nouveau-né qui nous a été rapporté récemment : naissance à terme (40 SA) d’une petite fille, ayant présenté des malaises graves avec désaturations secondaires à des apnées mixtes, obstructives et centrales, ainsi que des extrasystoles, ayant nécessité une prise en charge en néonatologie pendant 10 jours et un traitement par caféine. Aucune étiologie ou facteur de risque n’a été retrouvé en dehors d’un traitement maternel par CARIBAN® durant toute la grossesse (4 cps/j jusqu’à 4 mois de grossesse puis 1/j), pour des nausées persistantes. L’action sédative de la doxylamine a pu être impliquée au niveau central dans la survenue des apnées ; la présence d’extrasystoles interpelle également, en raison de l’action potentielle de la doxylamine sur la repolarisation cardiaque (augmentation de l’intervalle QT), bien documentée avec d’autres antihistaminiques H1 tels que l’hydroxyzine. Deux autres cas similaires ont été retrouvés dans la Base Nationale de Pharmacovigilance avec la doxylamine. Il a aussi été rapporté de manière informelle à notre centre l’utilisation de doxylamine tout au long de la grossesse par des patientes initialement traitées pour les nausées et vomissements du premier trimestre mais ayant poursuivi le traitement sans indication clairement définie.
Le fait que la doxylamine soit indiquée chez la femme enceinte est un facteur rassurant pour le prescripteur et la patiente mais son utilisation ne doit pas être prolongée sans réévaluation régulière de la balance bénéfices/risques et une surveillance de principe du nouveau-né est recommandée lors d’une utilisation prolongée jusqu’au terme.
Médicaments anti-obésité et Babybel : le « snacking sain »
Haleh Bagheri (Toulouse)
« Les Etats-Unis sont devenus le premier pays consommateur de Mini Babybel avec un tiers des volumes vendus, soit 20 000 tonnes par an, à comparer aux 8 000 tonnes écoulées en France » (1). L’entreprise Bel envisage pour 2027, l’extension de son usine américaine située à Brookings, dans le Dakota du Sud, dont la capacité de production est, actuellement, de 11 000 tonnes par an. Avec un nouvel emballage, la nouvelle version de Babybel est riche en protéine (20 % de protéines en plus par rapport à la recette classique), l’un des atouts de son succès aux USA. Bel commercialise aussi un ballot de deux portions de MiniBabybel, avec la promesse de 10 grammes de protéines. L’entreprise française vient, en outre, de signer un contrat de partenariat avec l’équipe de basket-ball des Chicago Bulls pour associer l’image de son produit de snacking au sport. C’est peut-être la première fois que la commercialisation d’un médicament comme les analogues GLP-1 fait non seulement le bonheur financier (valorisation des actions boursières) du laboratoire pharmaceutique (comme NovoNordisk) mais aussi d’autres entreprises sans aucun rapport avec l’industrie du médicament.
D’autres horizons restent ouverts pour les analogues GLP-1. Pourquoi pas des MiniBabybel ou des gummies contenant un analogue GLP-1 et en vente libre ! A l’image des vitamines, oligoéléments, antioxydants… sous forme de gummies inondant le marché.
Même l’OMS publie des lignes directrices (recommandations conditionnelles) sur l’utilisation des analogues GLP1 (2). Cette classe médicamenteuse s’est rajoutée à la liste des médicaments essentiels pour la prise en charge du diabète type 2.
- Le Monde. Laurence Girard. 3 Décembre 2025.
- www.who.int/fr/news/item/01-12-2025-who-issues-global-guideline-on-the-use-of-glp-1-medicines-in-treating-obesity
L’IMPACT ENVIRONNEMENTAL DES INHALATEURS : UNE PROBLÉMATIQUE À PLUSIEURS NIVEAUX
Clara Guillaume (étudiante), Marilou Duboëlle et Virginie Brès (Montpellier)
Les systèmes d’inhalation, et en particulier les inhalateurs doseurs pressurisés (IDP), suscitent une attention croissante en raison de leur empreinte carbone et de leur impact environnemental global. Bien que leur contribution globale aux gaz à effets de serre soit faible (≈ 0,03%), leur usage massif dans certains pays (États-Unis, Australie, Royaume-Uni) leur confère un rôle non négligeable dans la réflexion sur des pratiques de soins plus durables (1,2). Les IDP utilisent des gaz propulseurs à fort pouvoir de réchauffement, générant jusqu’à 48 kg de CO₂eq par dispositif, contre 1 kg pour les inhalateurs à poudre sèche (IPS) (2-3). En Italie par exemple, cela représente plus de 1000 tonnes de CO₂eq par an pour les IDP, contre 55 tonnes pour les IPS (4). En Australie, 98% des émissions liées aux inhalateurs proviennent des IDP, bien qu’ils ne représentent que 57% des prescriptions (5).
Les IPS, sans gaz propulseur, ont une empreinte 20 à 30 fois inférieure (1), avec une efficacité clinique comparable, y compris chez les patients atteints de BPCO (3-6). Leur substitution est encouragée par des sociétés savantes, mais le choix doit rester individualisé et dépend de la pathologie, de la capacité inspiratoire du patient, de la disponibilité des produits et du coût (2). L’adhésion des patients et des prescripteurs est cruciale : une étude britannique révèle que 85% des patients jugent important de réduire leur impact climatique et 59% seraient prêts à changer d’inhalateur s’ils connaissaient son empreinte environnementale (6). Le changement d’inhalateur nécessite toutefois un accompagnement pour éviter les erreurs d’utilisation, fréquentes en l’absence de supervision (2).
Au-delà des gaz à effets de serre, la gestion des déchets médicamenteux représente un enjeu environnemental majeur : résidus médicamenteux voire doses inutilisées et absence de filières de collecte adaptées exposent sols et eaux à des pollutions. Bien qu’ils représentent moins de 0,02% des déchets plastiques mondiaux, leur impact écologique pourrait être disproportionné en raison de ces traces médicamenteuses (1,2). En milieu hospitalier, une étude canadienne a montré que 81,9% des doses d’IDP sont gaspillées, générant plus d’une tonne de CO₂eq en trois mois (8). Des pratiques telles que la réutilisation contrôlée des IDP ou leur incinération pourraient réduire leur empreinte carbone d’un facteur 6 (9).
La réduction de l’impact environnemental des inhalateurs nécessite une approche globale. Substituer les IDP par des IPS lorsque cela est médicalement possible implique d’informer et d’impliquer patients et prescripteurs. Il est également essentiel de développer des filières efficaces de récupération des dispositifs. Agir sur l’ensemble du cycle de vie (prescription, utilisation, élimination) aide à concilier qualité des soins et responsabilité environnementale. Des actions simples peuvent déjà compter : renforcer l’éducation à l’usage et au retour des dispositifs, intégrer l’empreinte carbone dans le choix thérapeutique en cas d’options équivalentes et limiter les prescriptions inutiles (6-8,10,11).
Références
- de Boer AH. The environmental burden of inhalation. Eur J Pharm Sci. 2025;204:106893.
- Wurzel DF et al. Environmental impact of inhaled medicines: A Thoracic Society of Australia and New Zealand position statement. Respirology. 2025;30(2):101-112.
- Alkhunaizi M et al. Reducing Inhaler-Related Greenhouse Gas Emissions. JAMA. 2025;333(23):2051-2053.
- Mairhofer J et al. Comparing the CO₂ emissions of metered dose inhalers and dry powder inhalers. BMJ Open Respir Res. 2025;12(1):e002977.
- Kazda L et al. Estimated carbon emissions for PBS-subsidised prescription respiratory inhalers, Australia, 2019-2023. Med J Aust. 2025.
- Hodge A et al. The patient perspective on the environmental impact of inhalers. Respir Med. 2024;235:107864.
- Oosterveld B et al. Are we ready for climate-friendly inhaler prescription and usage? BMJ Open. 2025;15(7):e086484.
- Bentley A et al. Quantifying Financial and Environmental Implications of Wasted Inhaler Doses in the Hospital Setting. Can J Hosp Pharm. 2025;78(2):e3606.
- Loftus MJ et al. Use of metered dose inhalers for bronchodilator responsiveness testing. BMJ Open Respir Res. 2024;11(1):e002478.
- Goldak J et al. A stepwise approach for pharmacists in selecting climate-conscious inhaled therapy for COPD. Can Pharm J (Ott). 2024;158(1):12-19.
- Cushnahan A et al. Environmental impact of pressurised metered dose inhalers versus dry powder and soft mist inhalers. Intern Med J. 2024;54(11):1898-1902.
Vers une prescription plus verte ?
Romain Hacquet (AHU, Toulouse)
L’écopharmacovigilance, discipline émergente à l’interface de la pharmacovigilance et des sciences environnementales, vise à détecter, évaluer, comprendre et prévenir les effets indésirables des médicaments sur l’environnement (1).
Dans ce contexte, une étude transversale a été menée en Suède entre 2023 et 2024 auprès de médecins généralistes pour explorer la prise en compte de l’impact écologique dans leurs décisions de prescription (2). Le questionnaire incluait trois situations cliniques simulées, pour lesquelles les prescripteurs devaient choisir entre deux médicaments fictifs, présentant des niveaux variables d’efficacité thérapeutique et d’impact environnemental. Pour les 272 répondants, les choix de prescription tendaient vers des médicaments à efficacité moyenne et à impact écologique faible. Pour les antalgiques et antihypertenseurs, 77% des médecins privilégiaient le médicament le moins polluant, quitte à diminuer l’efficacité thérapeutique, tandis que pour les contraceptifs ce taux descendait à 50%. Par ailleurs, une large majorité des répondants soutenait une réglementation plus stricte sur les conséquences écologiques des médicaments. L’étude présentait certaines limites, notamment un faible taux de réponse limitant la représentativité des résultats. De plus, seulement 6% des répondants déclaraient rechercher des informations sur l’impact écologique d’un médicament, suggérant un écart entre ces situations simulées et la pratique clinique. Toutefois, cette étude souligne une sensibilité des prescripteurs suédois aux enjeux environnementaux liés aux médicaments.
En France, des recommandations récentes issues des Ateliers de Giens 2023 suggèrent la prise en compte de l’impact écologique du médicament, de sa conception, à sa fin de vie, en incluant la formation des professionnels de santé (3).
- Holm G, Snape JR, Murray-Smith R, Talbot J, Taylor D, Sörme P. Implementing ecopharmacovigilance in practice: challenges and potential opportunities. Drug Saf. 2013;36(7):533-546. doi:10.1007/s40264-013-0049-3
- Villén J, Laux J, Wettermark B, Sporrong SK, Nekoro M, Håkonsen H. Towards greener prescribing? Swedish general practitioners’ support for policies to reduce pharmaceutical pollution. Br J Clin Pharmacol. Published online April 27, 2025. doi:10.1002/bcp.70066
Potentiel de dépendance de la lisdexamfétamine : données précliniques et perspectives
Ghjulia Chautard (externe en Pharmacie), Margot Lestienne, Céline Eiden, Hélène Peyrière (Montpellier)
La lisdexamfétamine (LDX, spécialité XURTA®) a obtenu son AMM le 30 janvier 2025 pour le marché français. Ce médicament est indiqué en deuxième intention pour le traitement du TDAH de l’enfant de > 6 ans si échec du méthylphénidate. Elle est également indiquée pour le TDAH de l’adulte connu depuis l’enfance. Cela nécessite une prescription initiale réservée aux spécialistes (neurologues, pédiatres, psychiatres), avec une ordonnance sécurisée limitée à 28 jours pour la première délivrance. Ce médicament est non remboursé.
Cette prodrogue est clivée dans le sang en d-amphétamine, qui augmente la neurotransmission dopaminergique par inhibition de DAT (Dopamine Transporter)/NET (Norepinephrine transporter), interaction avec VMAT2 (Vesicular Monoamine Transporteur 2) et réduction de la dégradation par les MAO (Monoamine oxydase). Cette action pharmacologique améliore l’attention et la vigilance, mais active également le circuit mésolimbique, dit “circuit de la récompense”, impliqué dans les mécanismes d’addiction et de renforcement. La question du potentiel de dépendance se pose.
À la suite d’une étude in vivo, trois approches précliniques permettent d’évaluer son potentiel d’abus. Le test de préférence de place conditionnée chez la souris a mis en évidence un effet gratifiant dose-dépendant validé par un contrôle positif à la cocaïne, suggérant une activation comportementale du système de récompense. Puis le modèle d’auto-administration chez le rat, référence pour l’étude de la dépendance, confirme un effet renforçant significatif : les animaux s’auto-administrent davantage de LDX que le contrôle, reflet d’un potentiel addictif réel. Enfin, l’analyse sur synaptosomes striataux révèle une augmentation dose-dépendante de la libération de dopamine, moins marquée que celle de la méthamphétamine mais fondée sur des mécanismes similaires.
Bien que la cinétique lente de la prodrogue limite l’euphorie immédiate, caractéristique des amphétamines, la LDX partage plusieurs cibles moléculaires avec des psychostimulants addictogènes. Les résultats précliniques étayent ainsi la nécessité d’un encadrement strict et d’une surveillance clinique adaptée.
Un cas clinique rapporté dans la littérature illustre néanmoins une situation contrastée : chez un patient dépendant à la méthamphétamine, la LDX a amélioré les symptômes de TDAH tout en diminuant le craving pour les stimulants illicites. Ce cas reste isolé, mais soulève une autre question, celle du potentiel “agoniste” contrôlé de la LDX.
Ces données soulignent l’importance d’une évaluation nuancée et ouvrent la discussion : le potentiel addictif de la lisdexamfétamine mérite d’être mieux caractérisé par des études supplémentaires, tant cliniques que précliniques, afin de trouver l’équilibre optimal entre efficacité thérapeutique et prévention du risque.
Fleurs de cannabidiol adultérées par des cannabinoïdes de synthèse
Romain Hacquet, Nassima Redjimi, Maryse Lapeyre-Mestre (Toulouse)
Le cannabidiol (CBD) est souvent présenté comme un produit naturel dépourvu de risques, associé à des allégations thérapeutiques inappropriées. Compte tenu de l’absence de contrôle a priori des produits vendus au grand public, de plus en plus de produits commercialisés sous l’appellation CBD contiennent des substances plus dangereuses. En juillet 2025, le bulletin de l’association des centres d’addictovigilance signalait une hausse des cas graves liés à la consommation de produits vendus pour du CBD, adultérés par des cannabinoïdes de synthèse ou d’hémisynthèse, dont 75% achetés en boutique.1
En octobre 2025, le CEIP-A de Toulouse a reçu, via le portail de signalement des événements sanitaires indésirables, une déclaration d’une consommatrice habituelle de CBD. Après la consommation de fleurs de CBD achetées en boutique, elle a présenté palpitations, oppression et douleur thoracique, nausées, puis malaise avec chute, ayant conduit à une admission aux urgences. Avec une troponine augmentée (81 ng/mL pour une normale < 39 ng/l), l’absence d’autres anomalies biologiques, une échocardiographie et électrocardiogramme normaux, cette souffrance myocardique transitoire évoque une possible myocardite aigue toxique. Après un arrêt de travail prolongé et une reprise d’activité progressive, la patiente reste symptomatique plusieurs mois après cette exposition, avec un traitement antiagrégant plaquettaire au long cours. L’analyse du produit par le dispositif SINTES2 a mis en évidence du MDMB-4en-PINACA. Ce cannabinoïde de synthèse, à l’origine de plusieurs signalements en addictovigilance rapportant des troubles cardiovasculaires, est classé comme stupéfiant depuis 2021.
Ce cas confirme la possible vente en boutique d’une substance psychoactive puissante, sans étiquetage la mentionnant, conduisant à des expositions involontaires de substances illicites. En outre, l’adultération de fleurs de CBD par des cannabinoïdes de synthèse expose à des risques cardiovasculaires graves, justifiant de mettre en place des contrôles a priori de la qualité de ces produits vendus en boutique.

BIP Occitanie fait partie de l'International Society of Drug Bulletins (ISDB)